微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如下图所示。
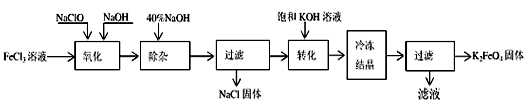
(1)写出“氧化”过程中反应的离子方程式:___________________________。
(2)写出“转化”过程中发生反应的化学方程式为_______________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用__________溶解,然后____________________。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为_________________________。
2、填空题 2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题。某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下:
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。

(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是_______________。
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求__________________________。
(3)写出反应④生成沉淀X的离子方程式:________________________?。
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的化学反应方程式:_____________________________。
(5)生成Li2CO3的化学反应方程式为___________________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应______________。
3、填空题 以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下
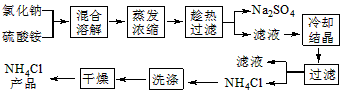

氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7 g NH4Cl,理论上需NaCl_________g。
(2)实验室进行蒸发浓缩用到的主要仪器有__________、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为__________。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是__________________________________________。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是_________________________。
4、填空题 碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题
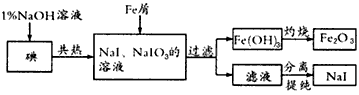
(1)判断碘是否已完全反应的实验方法是____________;
(2)将滤液在低温下分离出NaI样品过程中,要防止NaI被氧化,最好采取的措施是________________;
(3)测定产品中NaI含量的方法是:
a.称取3.000 g样品、溶解,在250 mL容量瓶中定容;
b.量取25. 00 mL待测溶液于锥形瓶中;
c.用0.1 000 mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19. 00 mL。
①上述测定过程所需仪器中,需要检查是否漏液的仪器有_____________。
②上述样品中NaI的质量分数为________________
③若用上述方法测定产品中NaI的质量分数偏低(测定过程中产生的误差忽略不计),其可能原因有
______________________
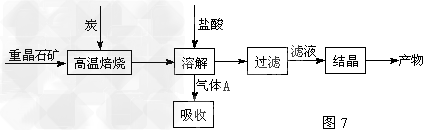
5、填空题 工业上制备BaCl2的工艺流程图如图7: 某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。?
已知:BaSO4(s)?+?4C(s)? 4CO(g)?+?BaS(s)?△H1?=?+571.2?kJ·mol-1?①
4CO(g)?+?BaS(s)?△H1?=?+571.2?kJ·mol-1?①
BaSO4(s)?+?2C(s)? 2CO2(g)?+?BaS(s)?△H2=?+226.2?kJ·mol-1?②
2CO2(g)?+?BaS(s)?△H2=?+226.2?kJ·mol-1?②
(1)高温焙烧时常把原料粉碎,目的是_________________________________
(2)常温下,相同浓度的Na2S和NaHS溶液中,说法正确的是:____________
A.?Na2S溶液的pH比NaHS溶液pH大
B.?两溶液中含有的离子种类不同
C.?两溶液中滴入同体积同浓度的盐酸,产生气体速率相?等
D.?两溶液中加入NaOH固体,c(S2-)都增大
E.?NaHS溶液中:c(Na+)?>?c(HS-)?>?c(OH-)?>?c(H+)?>?c(S2-)
(3)反应C(s)?+?CO2(g) ?2CO(g)的△H?=?___________
?2CO(g)的△H?=?___________
(4)制备BaCl2的工艺流程图?中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为:_________________
(5)实际生产中必须加入过量的炭,同时还要通入空气,目的是:________________(写出一种原因即可)。