微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 一定条件下,向某密闭容器中充入一定量的H2和I2蒸气,发生如下反应:
H2(g)+ I2(g)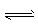 2HI(g),4 min末达到平衡,测得HI的物质的量浓度为0.4 mol/L。请回答:
2HI(g),4 min末达到平衡,测得HI的物质的量浓度为0.4 mol/L。请回答:
(1)该反应的速率为____。
A.v(H2) =0.2 mol/(L.min)
B.v(I2) =0.1 mol/(L.min)
C.v(HI) =0.1 mol/(L.min)
(2)该反应化学平衡常数的表达式是____。
A.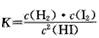
B.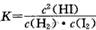
C.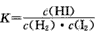
(3)保持其他条件不变,升高温度,HI的浓度减小。下列说法正确的是___。
A.该反应为放热反应
B.温度升高时,化学平衡常数不变
C.保持其他条件不变,减小容器体积,化学平衡向正反应方向移动
参考答案:(1)C
(2)B
(3)A
本题解析:
本题难度:一般
2、填空题 某反应A+B C在任意时刻的正、逆反应速率都可用v(正)、v(逆)表示,: v(正)=k1×c(A) ×c(B) v(逆)=k2×c(C),其中k1、k2在一定温度下恒为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度。
C在任意时刻的正、逆反应速率都可用v(正)、v(逆)表示,: v(正)=k1×c(A) ×c(B) v(逆)=k2×c(C),其中k1、k2在一定温度下恒为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度。
(1)上述反应达到平衡时,三种物质的物质的量浓度关系可表示为____________________。
(2)在300K时,开始反应的A、B的浓度均为0.1mol/L,达平衡时B的转化率为50%,则k1、k2之间的关系是____________________。
(3)升高温度k1、k2的变化是______________,k1/k2增大,说明正反应是_____________(填“放热”或 “吸热”)反应。
参考答案:(1) =
=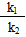
(2)k1=20k2
(3)k1,k2均变大;吸热
本题解析:
本题难度:一般
3、选择题 反应2X(g)+Y(g)═2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
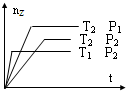
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
参考答案:C
本题解析:
本题难度:简单
4、填空题 反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
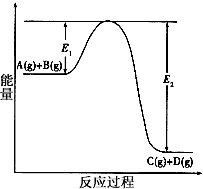
?(1)该反应是_________反应(填“吸热”、“放热”)。当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),
(2)在反应体系中加入催化剂, 反应速率增大,E的变化是_________,(填“增大”、“减小”或“不变”)理由是__________E的大小对该反应的反应热有无影响?____________ 。
参考答案:(1)放热 ;减小
(2)减小 ;改变反应的途径,降低了反应所需的活化能; 无影响
本题解析:
本题难度:一般
5、填空题 在汽车上安装催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)相互反应生成无毒害物质,减少汽车尾气污染。
(1)N2(g)+?O2(g)=2NO(g)?△H=+180.5?kJ/mol?
2C(s)+?O2(g)=2CO(g)?△H=-221.0?kJ/mol?
C(s)+?O2(g)=CO2(g)?△H=-393.5?kJ/mol?
写出NO(g)与CO(g)反应的热化学方程式____________________。
(2)某研究性学习小组在技术人员的指导下,在某温度时按下列流程探究催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表

①前2s内的平均反应速率v?(N2)?=__________。
②列式计算该温度下反应的平衡常数K_______________。
③对于该可逆反应,下列叙述正确的是___________(填序号)。
A.该反应在一定条件下能自发进行
B.该反应能有效减少有害气体的排放
C.该反应一旦发生将在很短的时间内完成?
D.该反应达到平衡时CO、NO的转化率相等
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列叙述错误的是____(填序号)。

A.负极的电极反应式为:CO+O2--2e-=CO2?
B.工作时O2-在固体介质中由电极a流向电极b
C.工作时电子由电极a通过电流计流向电极b
D.电流计中显示的电流越大,汽车尾气中CO的含量越高
参考答案:(1)2NO(g)+2CO(g)=N2(g)+2CO2(g)? △H=-746.5 kJ/mol
(2)①1.875×10-4 mol·L-1·s-1;②5.00 ×103;③ABC
(3)B
本题解析:
本题难度:一般