|
高考化学必考知识点《化学平衡》答题技巧(2017年最新版)(十)
2017-03-02 22:51:36
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 COCl2(g) 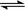 CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是 CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是
A.①表示随温度升高,平衡常数的变化
B.②表示加入催化剂,反应速率随时间的变化
C.③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化
D.④表示CO的体积分数随充入Cl2量的变化
|
参考答案:D
本题解析:A、正方应是吸热反应,升高温度平衡向正反应方向移动,平衡常数增大,A错误;B、随着反应的进行,反应速率逐渐降低,B错误;C、恒压条件下充入惰性气体,容器容积增大,平衡向体积增大的正反应方向进行反应物的转化率增大,C错误;D、增大生成物氯气的浓度,平衡向逆反应方向进行,CO的体积分数减小,D正确,答案选D。
考点:考查外界条件对反应速率和平衡状态的影响
本题难度:困难
2、填空题 在容积为V L的密闭容器中发生2NO2 2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。 2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
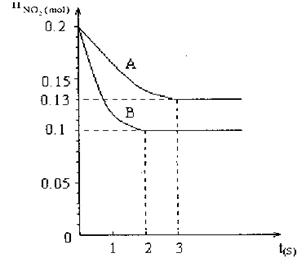
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是
A.有、无催化剂 B.压强不同 C.温度不同
(2)写出该反应的化学平衡常数K的表达式 ,并比较K800℃ K850℃(填>、<或=)。
(3)求在B条件下从反应开始至达到平衡,氧气的反应速率VO2= 。
(4)能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO)
B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变
D.气体的密度保持不变
参考答案:(1)C(2)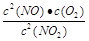 <(3) <(3)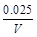 mol/(L·s)(4)AC mol/(L·s)(4)AC
本题解析:(1)B比A反应速率快但平衡时B比A中NO2物质的量小,催化剂对平衡移动无影响,所以不可能是使用催化剂。增大压强,平衡向左移动,NO2物质的量增大,B错误;升高温度,平衡向右移动,NO2物质的量减小,C正确。(2)该反应正反应是吸热反应,温度越高,K越大。(3)B条件下v(NO2)=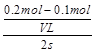 = =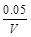 mol/(L·s),所以v(O2)= mol/(L·s),所以v(O2)=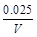 mol/(L·s)。(4)NO2与NO化学计量数相等,所以V正(NO2)=V逆(NO)是平衡状态,A正确;NO和NO2浓度相等不是平衡状态的标志,二者浓度不变是平衡状态的标志,B错误;气体的平均摩尔质量= mol/(L·s)。(4)NO2与NO化学计量数相等,所以V正(NO2)=V逆(NO)是平衡状态,A正确;NO和NO2浓度相等不是平衡状态的标志,二者浓度不变是平衡状态的标志,B错误;气体的平均摩尔质量= ,反应物和生成物都是气体,所以气体总质量守恒;反应后气体物质的量增大,气体平均摩尔质量减小,所以气体摩尔质量不变时是平衡状态,C正确;气体的密度= ,反应物和生成物都是气体,所以气体总质量守恒;反应后气体物质的量增大,气体平均摩尔质量减小,所以气体摩尔质量不变时是平衡状态,C正确;气体的密度=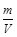 ,反应物和生成物都是气体,所以气体总质量守恒,容器容积固定,气体的体积不变,所以无论是平衡状态还是非平衡状态,气体的密度均不变,D错误。 ,反应物和生成物都是气体,所以气体总质量守恒,容器容积固定,气体的体积不变,所以无论是平衡状态还是非平衡状态,气体的密度均不变,D错误。
考点:勒沙特列原理 化学平衡常数 化学反应速率计算 化学平衡状态的标志
点评:图中曲线B达到平衡需要的时间比曲线A少,说明B条件下反应速率快,可能是浓度大、温度高、压强大、使用催化剂;再研究A、B条件下平衡时NO2物质的量可知B条件下NO2物质的量小,根据勒沙特列原理作出判断。
本题难度:一般
3、计算题 I.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g)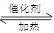 2SO3(g),2min末测得容器中有7.2mol SO2。试回答: 2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
① 反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③ 用O2的浓度变化表示该时间段内的化学反应速率_______________________。
II.某化学反应2A (g) B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验序号
| 时间
浓度
温度
| 0
| 10
| 20
| 30
| 40
| 50
| 60
| 1
| 800℃
| 1.0
| 0.80
| 0.67
| 0.57
| 0.50
| 0.50
| 0.50
| 2
| 800℃
| c2
| 0.92
| 0.75
| 0.63
| 0.60
| 0.60
| 0.60
| 3
| 820℃
| 1.0
| 0.40
| 0.25
| 0.20
| 0.20
| 0.20
| 0.20
|
?
根据上述数据,完成下列填空:
(1) 实验1达到平衡的时间是__________min,c2_____1.0 min·L-1(填“<”“>”或“=”)。
(2)实验3比实验1的反应速率_________(填“快”或“慢”),原因是___________________________________________________________________________。
(3) 如果2A (g) B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。 B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
参考答案:(12分)I.(1)①SO2、O2、SO3(2分) ?②0.4mol/L(1分)?③0.1mol/(L?min)(2分)
II.(1)40(1分)? >(1分)?
(2)快(1分)?实验3比实验1的温度高,反应速率快(2分)
(3)实验3中A的转化率大些(分解的A多些),正反应吸收热量多。(2分)
本题解析:I.(1)①首先,反应正向进行,生成的三氧化硫分子中含有18O;其次,可逆反应不仅能正向进行,也能逆向进行,三氧化硫分解产生的二氧化硫和氧气中也一定含有18O;因此,反应后中SO2、O2、SO3都含有18O;②依题意,可用三行数据法计算,即:
2SO2(g)+O2(g) 2SO3(g) 2SO3(g)
各组分的起始浓度/ mol?L-1? 4? 2? 0
各组分的变化浓度/ mol?L-1? 0.4? 0.2? 0.4
各组分2min末浓度/ mol?L-1? 3.6? 1.8? 0.4
则2min末SO3的浓度为0.4mol/L;
③v(O2)=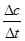 = =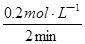 = 0.1 mol·L-1·min-1; = 0.1 mol·L-1·min-1;
II.(1)随着反应的正向进行,反应物A的浓度逐渐减小,当A的浓度保持不变时,说明反应达到平衡,读表中信息可得,实验1中达到平衡的时间是40min;(2)实验1、2的温度相同,则平衡常数相同,先用三行数据法求实验1的平衡常数,则:
2A (g)? ?B(g)? +? D(g) ?B(g)? +? D(g)
各组分的起始浓度/ mol?L-1? 1.0? 0? 0
各组分的变化浓度/ mol?L-1? 0.50? 0.25? 0.25
各组分的平衡浓度/ mol?L-1? 0.50? 0.25? 0.25
则实验1的平衡常数K= = =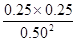 =0.25; =0.25;
再求实验2中A的起始浓度,则:
2A (g)? ?B(g)? +? D(g) ?B(g)? +? D(g)
各组分的起始浓度/ mol?L-1? c2? 0? 0
各组分的变化浓度/ mol?L-1? c2—0.60? 0.5 c2—0.30? 0.5 c2—0.30
各组分的平衡浓度/ mol?L-1? 0.60? 0.5 c2—0.30? 0.5 c2—0.30
则实验2的平衡常数K= = = =0.25,解得:c2="1.2" mol?L-1,则c2>1.0 mol?L-1; =0.25,解得:c2="1.2" mol?L-1,则c2>1.0 mol?L-1;
(2)820>800,则实验3的反应速率比实验1快,因为实验3的反应温度比实验1的高;(3)实验1变为实验3,其他条件保持不变,仅升高反应温度,平衡向吸热方向移动,若2A (g)  B(g)+D(g)是一个吸热反应,则平衡向正反应方向移动,则实验3中A的转化率大于实验1中,所以实验3吸收的热量较实验1多。 B(g)+D(g)是一个吸热反应,则平衡向正反应方向移动,则实验3中A的转化率大于实验1中,所以实验3吸收的热量较实验1多。
本题难度:困难
4、选择题 可逆反应aA(s)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( ) 
A.达到平衡后,加入催化剂则C%增大
B.达到平衡后,若升高温度,平衡向左移动
C.化学方程式中b>c+d
D.达平衡后,增加A的量,有利于平衡向右移动
参考答案:B
本题解析:
本题难度:简单
5、填空题 已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) 4NO(g)+6H2O(g)
(1)下列能说明该反应已经达到平衡状态的是?;
A.容器中气体总质量不变
B.c(O2)不变
C.υ(O2)=1.25υ(NH3)
D.体系压强不变
E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)向该容器中加入正催化剂,则反应速率?(选填“增大”、“减小”、“不变”,下同),降低容器的温度则反应速率?,通入Ar,则反应速率?。
(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是?。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢
参考答案:(11分)(1)BDE?(2)增大;减小;不变?(3)C
本题解析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项B正确。化学反应中一定满足质量质量守恒定律,A不能说明。速率之比是相应的化学计量数之比,因此C中的关系始终是成立,不正确。该反应是体积增大的可逆反应,则当压强不再发生变化时可以说明,D正确;E中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确,因此答案选BDE。
(2)催化剂能增大反应速率,而降低温度则减小反应速率。通入Ar,压强增大,但物质的浓度不变,则反应速率不变。
(3)由于该反应为放热反应,且反应在绝热密闭系统中进行。所以在反应开始阶段,主要受体系温度升高的影响,反应速率增大;而随着反应的进行,反应物的浓度逐渐降低,所以在反应后阶段,主要受浓度减小因素的影响,反应速率减慢,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。另外在判断外界条件对反应速率的影响时,应注意压强和浓度的适用范围。
本题难度:一般
|  B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。