微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)下表是元素 周期表的一部分,请回答下列问题:(用元素符号或对应化学式回答问题)
周期表的一部分,请回答下列问题:(用元素符号或对应化学式回答问题)
?族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
|
一
| ①
| ?
|
二
| ?
| ?
| ?
| ②
| ③
| ④
| ?
|
三
| ⑤
| ?
| ⑥
| ⑦
| ⑧
| ⑨
| ⑩
|
⑴ ④⑤⑥的原子半径由大到小的顺序为?
⑵ ②③⑦的最高价含氧酸的酸性由强到弱的顺序为?
⑶ ⑦⑧⑨的第一电离能由小到大的顺序为?
⑷比较④和⑨的氢化物的稳定性大小? ??,沸点高低?
??,沸点高低?
⑸写出元素⑩的 +1价含氧酸的结构式?
+1价含氧酸的结构式?
参考答案:(12分,每格2分)
⑴ Na>Al>O?⑵HNO3>H2CO3>H2SiO3?⑶Si<S<P
⑷H2O>H2S? H2O>H2S?⑸H—O—Cl
本题解析:略
本题难度:一般
2、选择题 把镁粉中混入的少量铝粉除去,应选用的试剂是
A.盐酸
B.氯水
C.烧碱溶液
D.纯碱溶液
参考答案:C
本题解析:盐酸跟镁、铝都反应,A错。氯水中存在游离氯,是氧化剂,金属都有还原性,是还原剂,镁、铝都会和氯反应;氯水中有氯和水反应的生成物——盐酸和次氯酸,镁、铝都会跟酸反应,B错。烧碱是氢氧化钠,铝有两性可以跟氧氧化钠溶液反应放出氢气,铝变成偏铝酸钠溶于水,镁不反应而分离。
2Al+2NaOH+2H2O====2NaAlO2+3H2↑
C对。纯碱溶液,是碳酸钠溶液,镁、铝都不反应,D错。
本题难度:简单
3、选择题 下列递变情况正确的是( )
A.Na、Mg、Al最外层电子数依次增多,其还原性依次增强
B.P、S、Cl最高正价依次升高,对应气态氢化物稳定性依次增强
C.C、N、O原子半径依次增大
D.Na和K属于第ⅠA族元素,其氧化物的水化物碱性:NaOH比KOH强
参考答案:B
本题解析:考查元素周期律的应用。同周期元素自左向右最外层电子数逐渐增多,最高正价逐渐升高,原子半径逐渐增大,金属性逐渐减弱,非金属性逐渐增强。同主族元素自上而下金属性逐渐增强,所以正确的答案是B。
本题难度:一般
4、选择题 采用不同的分类方法,可将非金属氧化物分为不同的类别,例如,从某种意义上讲可将P2O5、SO2、SO3、CO2、Cl2O7等归为一类,则下列氧化物中与它们不属一类的是
A.CO
B.SiO2
C.Al2O3
D.Fe2O3
参考答案:A
本题解析:本题考查了基本概念,题干中所给氧化物都是酸酐,都属于成盐氧化物,而题目所给选项中,SiO2、Al2O3、Fe2O3都可以形成盐,只有CO不可以.
本题难度:一般
5、填空题 下表是元素周期表的一部分,针对表中①~⑩中的元素,回答以下问题:
①
| ?
| ?
|
?
| ?
| ?
| ?
| ②
| ③
| ④
| ⑤
| ?
|
⑥
| ⑦
| ⑧
| ?
| ?
| ?
| ⑨
| ?
|
| ?
| ?
| ?
| ?
| ?
| | ?
| ?
| ?
| ?
| ?
| ?
| ?
| | ?
| ⑩ | ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)在表中a、b、c、d四个区域中,全部是金属元素的区域为 ?。
(2)在①~⑨元素中,原子半径最大的是? ?(填元素名称);①和③组成的化合物的电子式为?;⑨的离子结构示意图为?。
(3)元素的最高价氧化物对应的水化物中酸性最强的是?(填化学式,下同),碱性最强的是 ?,呈两性的是?。
(4)⑨和⑩中,非金属性较强的是?(填元素符号);可用一个化学反应说明该事实,写出该反应的离子方程式:?。
参考答案:(每空1分,共9分)
(1)b
(2)钠,?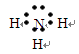 ?,
?,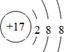 ?
?
(3)HClO4,NaOH,Al(OH)3?
(4)Cl, Cl2+2Br-=2Cl-+Br2
本题解析:(1)b的区域中是过度金属,故全部是金属元素的区域b。
(2)同周期,自左向右,原子半径逐渐减小;同主族,自上向下,原子半径逐渐增大。故原子半径最大的是⑥,即钠。①和③组成的化合物是NH3,电子式为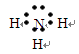 。⑨是Cl,其离子结构示意图为
。⑨是Cl,其离子结构示意图为 。
。
(3)同周期,自左向右,金属性逐渐减弱,非金属性逐渐增强;同主族,自上向下,金属性逐渐增强,非金属性逐渐减弱。元素的非金属性越强,其最高价氧化物对应的水化物中酸性最强,故为HClO4。元素的金属性越强,其最高价氧化物对应的水化物碱性最强的,故为NaOH。呈两性的是Al(OH)3。
(4)同周期,自左向右,金属性逐渐减弱,非金属性逐渐增强;同主族,自上向下,金属性逐渐增强,非金属性逐渐减弱。故非金属性⑨大于⑩,非金属性较强的是Cl。证明非金属性强弱的化学反应的离子方程式为Cl2+2Br-=2Cl-+Br2。
点评:本题考查学生元素周期表和元素周期律的综合知识,是一道综合题,难度较大。
本题难度:一般