| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《离子共存》考点预测(2017年强化版)(二)
参考答案:A 本题解析:略 本题难度:一般 2、选择题 一定能在下列溶液中大量共存的离子组是 |
参考答案:D
本题解析:①能使甲基橙变黄色的溶液可能酸性也可能呈碱性:Na+、S2-、Cl—、SO32-不一定大量共存。②室温,溶液中水电离出的H+、OH—浓度的乘积为10-28说明水的电离受到抑制,溶液可能为酸溶液或碱溶液:Mg2+不一定能存在。③AlO2—+HCO3—+H2O=Al(OH)3↓+CO32-,故二者不能共存。④澄清透明的溶液,溶液中c(H+)=10-2mol/L的溶液中溶液呈酸性:Cu2+、Na+、SO42—、Cl—可共存。⑤在加入Al能放出大量气体的溶液可能为强酸溶液也可能为强碱溶液,若为强碱溶液生成大量氢气,若为强酸溶液生成NO气体。故可共存。⑥Cr3+溶液呈现出紫色。
综合上述分析选D。
考点:认识离子共存,了解常见物质的性质。
点评:判断离子是否共存注意题目给出的附加条件,如:溶液的颜色、强酸性溶液(H+)、强碱性溶液(OH-)、能在加入铝粉后放出气体的溶液、由水电离出的H+或OH-=1×10-13mol/L的溶液,等等。
本题难度:困难
3、选择题 下列表示正确的是(?)
A.用碳酸钠溶液吸收少量二氧化硫: 2CO32-+SO2+H2O =2HCO3-+SO32-
B.CO(g)的燃烧热是283.0kJ·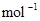 ,则
,则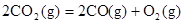 反应的
反应的
C.含有大量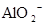 的溶液中:K+、
的溶液中:K+、 、
、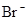 、
、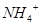 可共存
可共存
D.在某钠盐溶液中含有等物质的量的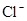 、
、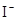 、
、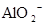 、
、 、
、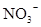 、
、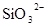 中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有
中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有
参考答案:A
本题解析:酸性:亚硫酸强于碳酸,所以向碳酸钠溶液中通入少量二氧化硫发生反应产生亚硫酸钠和碳酸氢钠,从而可以用来吸收二氧化硫气体。反应的离子方程式是:2CO32-+SO2+H2O =2HCO3-+SO32-。正确。B.一氧化碳燃烧放热,则二氧化碳分解吸热。故2CO2(g)=2CO(g)+O2(g)反应的反应热为ΔH=+566KJ/mol.错误。C. 含AlO2-的溶液显碱性,在碱性溶液中NH4+不能大量存在。错误。D.加入过量盐酸时H+?、I-、 NO3-发生氧化还原反应产生NO气体和I2,I2使溶液颜色加深,AlO2-反应转化为Al3+,SiO32-与氢离子反应产生硅酸沉淀。所以即使没有碳酸根离子也会有气泡产生。故错误。
本题难度:一般
4、选择题 下列各组离子,一定能大量共存的是:
A.常温下,c(H+)/c(OH-)=1×10-12的溶液:I-、Cl-、HCO3-、Na+
B.含有大量Fe3+的溶液:Na+、HCO3-、NO3-、CO32-
C.加入铝粉能产生氢气的溶液:NH4+、Fe2+、SO42-、Cl-
D.由水电离出的c(H+)=1×10-12 mol?L-1溶液中:K+、Cl-、NO3-、Na+
参考答案:D
本题解析:A c(H+)/c(OH-)=1×10-12的溶液显碱性,HCO3-在碱性环境中不存在。
B Fe3+与HCO3-双水解,不共存
C 加入铝粉能产生氢气的溶液可能显酸性,也可能显碱性,但碱性环境中不存在
D 由水电离出的c(H+)=1×10-12 mol?L-1溶液可能显酸性,也可能显碱性,这些离子都可以共存。故选D 。
本题难度:简单
5、选择题 某硝酸银溶液中含有Ag+、Ba2+、Mg2+,为了将这三种离子逐一进行沉淀分离,加入下列物质先后顺序正确的是(? ?)
?)
A.Na2CO3 、NaCl 、NaOH
B.NaCl 、Na2CO3 、NaOH
C.NaOH 、NaCl 、Na2CO3
D.NaCl 、NaOH 、Na2CO3
参考答案:D
本题解析:略
本题难度:简单
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点归纳《化学与生活.. | ||