微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 短周期元素X、Y、Z、W的原子序数依次增大,X是形成化合物最多的元素且X常见化合价为+1和-1,Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍。下列叙述不正确的是( )
A.原子半径的大小顺序:rZ>rW>rY>rX
B.元素Y的简单气态氢化物的热稳定性比W的弱
C.化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂
D.由X、Y、Z、W四种元素组成的化合物其水溶液一定显酸性
参考答案:B
本题解析:X是形成化合物最多的元素且常见化合价为+1和-1,则X为H;Y的最外层电子数是次外层的3倍,则Y为O;Z与X同一主族且原子序数大于O,则Z为Na;W的原子序数为Y的2倍,即W为S。B项,O的非金属性大于S,则气态氢化物的热稳定性:H2O>H2S,B错;D项,NaHSO3溶液呈酸性,D正确。
本题难度:一般
2、填空题 [2012·北京大兴一模](11分)下表为元素周期表的一部分,请参照①-⑦相关元素在表中的位置,用化学用语回答下列问题:
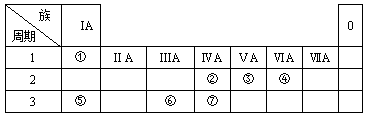
(1)④、⑤、⑥的原子半径由大到小的顺序为?;②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是?。
(2)由②④⑤三种元素组成的常见物质的水溶液显碱性,用离子方程式表示溶液显碱性的原因:________?___。
(3)甲、乙是由②③④三种元素中一种或两种元素形成的双原子分子或负二价阴离子,它们的电子总数相等,甲与钙元素组成的化合物既含离子键又含非极性共价键,则该化合物的电子式为:__________,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:__________?__。
(4)已知在25℃、101 kPa下,⑦的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移l mol电子时放热190.0kJ,该反应的热化学方程式可表示为____?。
(5)以⑥的单质材料为阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成有吸附性的难溶物R,写出阳极生成R的电极反应式:_______?____。
参考答案:(11分)(1)Na>Al>O?HNO3>H2CO3>H2SiO3?
(2)CO32-+H2O HCO3-+OH-
HCO3-+OH-
(3)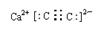 ?3CO+Fe2O3
?3CO+Fe2O3 2Fe+3CO2?
2Fe+3CO2?
(4)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)?ΔH=-1520.0 kJ·mol-1
(5)Al-3e-=Al3+?Al3++3HCO3-=Al(OH)3↓+3CO2↑或Al-3e-+3HCO3-=Al(OH)3↓+3CO2↑
本题解析:(1)④、⑤、⑥分别是O、Na、Al,据它们在周期表中的位置可知,原子半径由大到小的顺序为Na>Al>O;②、③、⑦分别是C、N、Si,据它们在周期表中的位置可知,三种元素非金属性强弱顺序为N>C>Si,故它们的最高价含氧酸的酸性由强到弱的顺序为HNO3>H2CO3>H2SiO3。
(2)由C、O、Na三种元素组成的常见物质是Na2CO3,Na2CO3是强碱弱酸盐,因CO32-的水解溶液呈碱性。
(3)C、N、O三种元素中一种或两种元素形成的双原子分子或负二价阴离子有N2、O2、CO、NO、C22-和O22-,其中N2、CO和C22-的电子总数均为14,符合题设条件的甲、乙分别是C22-和CO。甲与钙元素组成的化合物是CaC2,其电子式为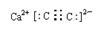 ;CO在工业上用于铁的冶炼。
;CO在工业上用于铁的冶炼。
(4)Si的氢化物的分子式为SiH4,SiH4完全燃烧的化学方程式为SiH4+2O2=SiO2+2H2O,1molSiH4完全燃烧转移8mol e-,同时放出热量:190.0kJ×8=1520.0 kJ,所以SiH4完全燃烧的热化学方程式是SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)?ΔH=-1520.0 kJ·mol-1。
(5)用Al作阳极电解NaHCO3溶液时,Al失去电子生成Al3+,Al3+在阳极附近与溶液中的HCO3-发生双水解反应生成有吸附性的难溶物Al(OH)3,同时放出CO2气体。
本题难度:一般
3、填空题 (9分)A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2。C、D的电离能数据如下(kJ·mol―1):
?
| I1
| I2
| I3
| I4
|
C
| 738
| 1451
| 7733
| 10540
|
D
| 577
| 1817
| 2745
| 11578
|
?
(1)化合价是元素的一种性质。由C、D的电离能数据判断,C通常显?价,D显?价;
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含___个σ键,___个π键;
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是______________________________
?
?
| 单键
| 双键
| 叁键
|
AB
| 键能(kJ·mol―1)
| 357.7
| 798.9
| 1071.9
|
甲
| 键能(kJ·mol―1)
| 154.8
| 418.4
| 941.7
|
?
(4)E能与AB形成配合物,其中E提供______________,AB提供________________。
(5)下列晶胞中,阳离子与阴离子的个数为?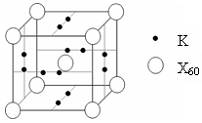
参考答案:

本题解析:略
本题难度:简单
4、选择题 下列叙述中,能说明金属M的金属性比金属N的金属性强的是
A.M原子的最外层电子数比N原子的最外层电子数少
B.常温时,M单质能从水中置换出氢气,而N单质不能反应
C.1mol M从稀H2SO4中置换出的H2比l mol N从稀H2SO4中置换出的H2多
D.在最高价氧化物的水化物中,M的化合价比N高。
参考答案:B
本题解析:略
本题难度:简单
5、选择题 .下列说法不正确的是:
A.若把HF分子写成H2F分子,违反了共价键的饱和性
B.若把碳的轨道式写成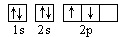 则违反了泡里不相容原理
则违反了泡里不相容原理
C.若把Be的基态电子排布式写成1s22s12p1 则违反了能量最低原理
D.若把氧的轨道式写成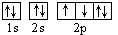 则违反了洪特规则
则违反了洪特规则
参考答案:D
本题解析:D.根据构造原理,四个量子数描述核外电子运动状态。能层、能级、轨道、自旋;同一能级分不同轨道,2p轨道有三个,能量相同,只是伸展方向不同,2p的三个轨道等价。
本题难度:简单