微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 实验室要用98%(密度为1.84g?cm-3)的硫酸配制3.68mol/L的硫酸500mL.实验步骤如下:
①计算所用浓硫酸的体积?②量取一定体积的浓硫酸?③溶解
④转移、洗涤?⑤定容、摇匀
回答下列问题
(1)需准确量取98%的硫酸______mL.量取浓硫酸所用的量筒的规格是______
(从下列中选用?A.10ml?B.20ml?C.50ml?D.100ml)
(2)要配制3.68mol/L的硫酸500mL,必须用到的仪器是(填写序号)______.
①500mL量筒 ②烧杯 ③1?000mL容量瓶 ④500mL容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒
(3)若配制3.68mol/L的硫酸,其他操作均正确,下列操作会使所配硫酸溶液浓度偏低的是______(选填序号).
A.将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外
C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切
D.用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切
E.所用的浓硫酸长时间放置在密封不好的容器中
(4)若配制时,因加水不慎超过了容量瓶刻度线,此时实验应如何继续进行?______.
参考答案:(1)浓硫酸的浓度=C=103ρwM=103×1.84×98%98mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=3.68mol/L×0.5L,V=0.1L=100mL,量取浓硫酸所用的量筒的规格是100mL,故答案为:100;D;?
(2)需要的仪器有:用于稀释浓硫酸的烧杯、配制溶液的500mL容量瓶、定容用的胶头滴管、引流和搅拌使用的玻璃棒,故选②④⑥⑧;
(3)A.将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒,溶质的物质的量偏小,配制溶液的浓度偏低;
B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外,溶质的物质的量偏小,配制溶液的浓度偏低;
C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切,溶质的物质的量偏小,配制溶液的浓度偏低;
D.用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切,溶液体积偏大,配制溶液浓度偏低;
E.所用的浓硫酸长时间放置在密封不好的容器中,溶质的物质的量偏小,配制溶液浓度偏低;
故选ABCDE;
(4)若配制时,因加水不慎超过了容量瓶刻度线,需要重新配置,故答案为:重新配置.
本题解析:
本题难度:一般
2、填空题 在KCl、ZnCl2、ZnSO4三种盐配成的混合溶液中,已知K+为0.1 mol,Zn2+为0.25 mol,Cl?为0.2 mol,则SO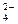 为______________mol。
为______________mol。
碱式碳酸铜受热会完全分解,Cu2(OH)2CO3 H2O+2CuO+CO2↑,则120 ℃时分解产生的混合气体的平均相对分子质量是___________。
H2O+2CuO+CO2↑,则120 ℃时分解产生的混合气体的平均相对分子质量是___________。
成年男子的肺活量为3 500~4 000 mL,成年女子的肺活量约为2 500~3 500 mL,肺活量较大的男子与肺活量较小的女子所容纳气体的物质的量之比为(在同温同压下)_________。
参考答案:0.2 mol? 31? 8∶5
本题解析:同一溶液中阴、阳离子所带电荷总数相等,即整个溶液呈电中性,由电荷守恒得:n(K+)+2n(Zn2+)=n(Cl-)+2n(SO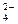 ),n(SO
),n(SO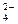 )=
)=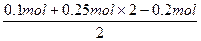 ="0.2" mol;碱式碳酸铜受热完全分解,产生的n(H2O)∶n(CO2)=1∶1,故
="0.2" mol;碱式碳酸铜受热完全分解,产生的n(H2O)∶n(CO2)=1∶1,故 =18×
=18×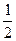 +44×
+44×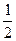 =31;同温同压下,气体的体积比等于物质的量之比,故n(大)∶n(小)="4" 000 mL∶2 500 mL=8∶5。
=31;同温同压下,气体的体积比等于物质的量之比,故n(大)∶n(小)="4" 000 mL∶2 500 mL=8∶5。
本题难度:简单
3、选择题 等质量的下列物质中,所含分子数最少的是
[? ]
A.Cl2
B.H2SO4
C.NH3
D.HCl
参考答案:B
本题解析:
本题难度:简单
4、填空题 人造空气(氧气和氦气的混合气体)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,5.6 L“人造空气”的质量是2.4 g,其中氧气与氦气和体积比是______ ,氧气的质量是______。
参考答案:氧气与氦气和体积比是__1:4____,氧气的质量是__1.6g____ 。
本题解析:略
本题难度:简单
5、填空题 (12分) 某一反应体系中,有反应物和生成物共六种物质,这六种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中KMnO4 → MnCl2。
(1)该反应中的化学方程式为_____________________________________________。
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________________________。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中被氧化的物质为________ NA(NA表示阿伏伽德罗常数的值)。
(4)市售的浓盐酸(密度为1.19g/cm3)在工业上是用500 L HCl气体(标准状况)与1 L H2O的比例配制成的,则该盐酸的物质的量浓度是___________mol/L(结果保留一位小数)。
(5)现需用1.20 mol/L的稀盐酸480  mL, 应量取市售浓盐酸________mL进行配制。
mL, 应量取市售浓盐酸________mL进行配制。
(5)取6.00 g硬铝合金(假设只含铝铜硅),与 (5) 中所配稀盐酸进行充分反应,收集到气体5.60 L(标准状况),则硬铝合金中铝的质量分数为____________。
参考答案:(共12分) (1) 2KMnO4 + 16HCl =" 2KCl" + 2MnCl2 + 5Cl2↑ +8H2O(2分)
( 2) 5∶2(2分)(3) 0.2(2分)(4) 14.6(2分)
2) 5∶2(2分)(3) 0.2(2分)(4) 14.6(2分)
(5) 41.1(2分)(6) 75%(2分)
本题解析:略
本题难度:简单