微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (本题共14分)自然界中,金属硫化物矿床常因发生表生氧化及次生富集作用,产生辉铜矿(Cu2S)与铜蓝(CuS)。
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别与100mL 5mol/L的稀硝酸充分反应,样品质量与产生气体的体积(已折合成标准状况)如下表所示:
实验编号
| 甲
| 乙
| 丙
|
样品质量(g)
| 9.6
| 12.8
| 64.0
|
气体体积(L)
| 5.04
| 6.72
| V
|
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
53.用质量分数为0.63、密度为1.42g/cm3的浓硝酸配置100mL、5mol/L的稀硝酸,需浓硝酸的体积为 。(保留1位小数)
54.甲实验结束后,溶液中c(NO3-) = 。
55.混合物样品中Cu2S、CuS的物质的量之比是多少?(写出计算过程)
56.乙实验结束后,溶液中氢离子的浓度是多少?(写出计算过程)
57.计算丙实验中产生气体的体积(V)。(写出计算过程)
参考答案:53、35.2mL (2分) 54、2.75mol/L (2分)
55、解:设12.8g的样品中CuS的物质的量为x ,Cu2S的物质的量为y
96x+160y=12.8
8x/3+10y/3=0.3
解得:x=y=0.05mol
根据方程式①、②可知消耗n(H+)=0.05mol×8/3+0.05mol×16/3=0.4mol
故剩余n(H+)=0.1mol,c(H+)=1mol/L (4分)
56、解:根据方程式①、②可知消耗n(H+)=0.05mol×8/3+0.05mol×16/3=0.4mol
故剩余n(H+)=0.1mol,c(H+)=1mol/L (2分)
57、解:首先判断64g样品中CuS、Cu2S的物质的量为0.25mol
若HNO3均与CuS反应:硝酸不足,则V(NO)=0.5mol×22.4L/mol=11.2L
若HNO3均与Cu2S反应:硝酸不足,则V(NO)=0.5mol×22.4L/mol=7L
所以:丙中产生气体体积(V):7L< V < 11.2L (4分)
本题解析:53、用质量分数为0.63、密度为1.42g/cm3的浓硝酸配置100mL、5mol/L的稀硝酸,需浓硝酸的体积为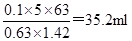 ;
;
54、根据甲、乙数据可知甲中硝酸过量,根据氮原子守恒可知被还原的硝酸的物质的量是5.04L÷22.4L/mol=0.225mol,则剩余硝酸根的物质的量是0.1L×5mol/L-0.225mol=0.275mol,剩余反应后溶液中c(NO3-) =0.275mol÷0.1L=2.75mol/L;
55、设12.8g的样品中CuS的物质的量为x ,Cu2S的物质的量为y
96x+160y=12.8
8x/3+10y/3=0.3
解得:x=y=0.05mol
根据方程式①、②可知消耗n(H+)=0.05mol×8/3+0.05mol×16/3=0.4mol
故剩余n(H+)=0.1mol,c(H+)=1mol/L
56、根据方程式①、②可知消耗n(H+)=0.05mol×8/3+0.05mol×16/3=0.4mol
故剩余n(H+)=0.1mol,c(H+)=1mol/L
57、首先判断64g样品中CuS、Cu2S的物质的量为0.25mol
若HNO3均与CuS反应:硝酸不足,则V(NO)=0.5mol×22.4L/mol=11.2L
若HNO3均与Cu2S反应:硝酸不足,则V(NO)=0.5mol×22.4L/mol=7L
所以:丙中产生气体体积(V):7L< V < 11.2L
考点:考查硝酸与铜的硫化物反应的有关计算
本题难度:困难
2、选择题 在配制一定物质的量浓度的盐酸溶液时,下列错误操作可使所配制溶液浓度偏高的是
[? ]
A.用量筒量取浓盐酸时俯视读数
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
参考答案:C
本题解析:
本题难度:一般
3、选择题 若NA表示阿伏加德罗常数,下列说法中错误的是
A.0.1mol/L稀硫酸中含有硫酸根离子个数为0.1NA
B.32g O2与O3混合气体中含有原子数为2NA
C.1molMg与足量N2反应生成Mg3N2失去的电子数为2NA
D.1mol H2和O2的混合气体在标准状况下的体积约为22.4L
参考答案:A
本题解析:A、没有说明溶液的体积,因此无法判断溶液中硫酸根离子的个数,故A错误;B、O2与O3混合气体中只含有O原子,因此可对O原子个数进行计算,故B正确;C、1molMg与足量N2反应生成Mg3N2化合价由0价升至+2价,转移电子数为2NA,故C正确;D、1mol不相互反应的任何气体在标准状况下的体积均为22.4L。
本题难度:一般
4、选择题 下列叙述正确的是
A.氢氧化钠的摩尔质量是40 g
B.1 mol NaOH的质量是40 g/mol
C.1 g H2和1 g N2所含分子数相等
D.阿伏伽德罗常数个钠原子的质量是23g
参考答案:D
本题解析:A错,摩尔质量的单位为g/mol;B错,质量的单位是g;C错,1 g H2和1 g N2的物质的量不相等即所含分子数不相等;D正确,阿伏加德罗常数个钠原子的物质的量为1mol,即质量为23g。
本题难度:简单
5、填空题 (6分)将质量比为15∶7的NO和N2混合,则混合气体中NO和N2的物质的量之比为 ?;氧原子和氮原子的个数之比为 ; 22 g该混合气体在标准状况下的体积为 L。
参考答案:(每空2分,共6分)?2∶1? 1∶2?16.8
本题解析:NO和氮气的相对分子质量分别是30和28,所以混合气体中NO和N2的物质的量之比为15/30︰7/28=2∶1;根据化学式可知,氧原子和氮原子的个数之比为2︰(2+2)=1∶2;22 g该混合气体含有15g氧气和7g氮气,物质的量分别是0.5mol、0.25mol,所以在标准状况下的体积是0.75mol×22.4L/mol=16.8L。
本题难度:一般