微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生以下变化:
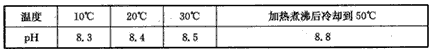
(1)甲同学认为,该溶液pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为____。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了 Na2CO3,并推断Na2CO3的水解程度____(填“大于”或“小于”)NaHCO3,该分解反应的化学方程式为____。
丙同学认为甲、乙的判断都不充分。
丙认为:
(3)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则____(填“甲”或“乙”)判断正确。试剂 X是________。
A.Ba(OH)2溶液
B.BaCl2溶液
C.NaOH溶液
D.澄清的石灰水
(4)将加热后的溶液冷却到10℃,若溶液的pH____(填“高于”、“低于”或“等于”)8.3,则____(填 “甲”或“乙”)判断正确。
(5)查阅资料,发现NaHCO3的分解温度为150℃,丙断言____(填“甲”或“乙”)的判断是错误的,理由是____。
2、选择题 1943年,侯德榜先生研究成功了联合制碱法,该方法不仅提高了食盐的利用率,还在得到纯碱的同时获得了重要的副产品氯化铵。下列关于Na2CO3溶液和NH4Cl溶液的说法正确的是
A.适当升温,两溶液的pH均增大
B.常温下pH=10的碳酸钠溶液与pH=4的氯化铵溶液中水的电离程度相同
C.0.1 mol/L Na2CO3溶液中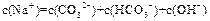
D.0.1 mol/L NH4Cl溶液中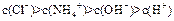
3、填空题 (12分)在常温下,下列五种溶液:
①0.1mol/L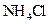 ? ②0.1mol/L
? ②0.1mol/L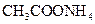 ? ③0.1mol/L
? ③0.1mol/L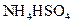
④0.1mol/L 和0.1mol/L
和0.1mol/L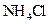 混合液? ⑤0.1mol/L
混合液? ⑤0.1mol/L
请根据要求填写下列空白:
(1)溶液①呈?性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
(2)在上述五种溶液中,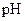 最小的是?;
最小的是?;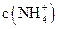 最小的是?(填序号)
最小的是?(填序号)
(3)比较溶液②、③中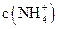 的大小关系是②?③(填“>”、“<”或“=”)
的大小关系是②?③(填“>”、“<”或“=”)
(4)在溶液④中,?离子的浓度为0.1mol/L; 和?离子的物质的量浓度之和为0.2mol/L。
和?离子的物质的量浓度之和为0.2mol/L。
(5)常温下,测得溶液②的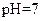 ,则说明
,则说明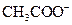 的水解程度?(填“>”、“<”或“=”)
的水解程度?(填“>”、“<”或“=”)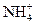 的水解程度,
的水解程度,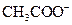 与
与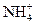 浓度的大小关系是:
浓度的大小关系是:
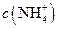 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
4、选择题 25℃时,氢氟酸的Ka=6.8×10-4,醋酸的Ka=1.8×10-5。如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系。则Y可以表示

[? ]
A.溶液的pH
B.水解平衡常数
C.水解百分率
D.溶液中阴离子浓度之和
5、选择题 常温下将浓度均为0.1 mol / L的CH3COOH和CH3COONa两溶液等体积混合,混合溶液的pH<7,有关叙述正确的是(?)
A.c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.向混合后的溶液中滴入NaOH溶液至pH=7,则有c(Na+)=c(CH3COO—)
D.混合溶液加水稀释,c(OH— )减小