微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某探究小组利用丙酮的溴代反应(CH3COCH3+Br2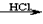 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据
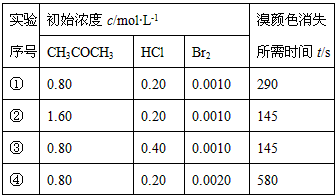
分析实验数据所得出的结论不正确的是
[? ]
A.增大c(CH3COCH3), v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl), v(Br2)增大
D.增大c(Br2),v(Br2)增大
参考答案:D
本题解析:
本题难度:一般
2、选择题 实验室用Zn与稀H2SO4反应来制取氢气,常加少量CuSO4来加快反应速率。为了研究CuSO4的量对H2生成速率的影响,某同学设计了实验方案(见下表),将表中所给的试剂按一定体积混合后,分别加入四个盛有相同大小的Zn片(过量)的反应瓶(甲、乙、丙、丁)中,收集产生的气体,并记录收集相同体积的气体所需的时间。
实验
试剂
| 甲
| 乙
| 丙
| 丁
|
4 mol·L-1H2SO4/mL
| 20
| V1
| V2
| V3
|
饱和CuSO4溶液/mL
| 0
| 2.5
| V4
| 10
|
H2O/mL
| V5
| V6
| 8
| 0
|
收集气体所需时间/s
| t1
| t2
| t3
| t4
|
下列说法正确的是
A.t1 < t2 < t3 < t4 B.V4=V5=10 C.V6=7.5 D.V1<V2<V3<20
参考答案:C
本题解析:研究的是硫酸铜的量对反应速率的影响所以方案中硫酸的用量必须相等,所以V1=V2=V310,溶液的总体积也必须相等,所以V5=10,V6=10-2.5=7.5,V4=10-8=2,随着硫酸铜量的增加反应速率增大,但是若硫酸铜过多会造成锌与硫酸铜反应生成大量的铜单质附着在锌片的表面阻止了锌与硫酸的接触反应速率反而会减小,所以速率最小的是 t4,综上应该选C。
本题难度:一般
3、选择题 对于工业合成氨反应:N2+3H2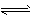 2NH3,下列说法错误的是
2NH3,下列说法错误的是
[? ]
A.使用合适的催化剂可以增大反应速率
B.升高温度可以增大反应速率
C.增大N2浓度可以使H2转化率达到100%
D.增大N2浓度可以增大反应速率
参考答案:C
本题解析:
本题难度:一般
4、选择题 将等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加少量组成原电池的条件CuS04溶液,下列各图中产生H2的体积V(L)与时间t(min)的关系如图所示,其中正确的是( )
A.

B.
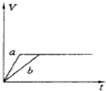
C.
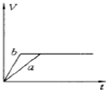
D.
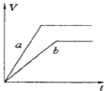
参考答案:等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,发生的反应为:
Fe+Cu2+=Fe2++Cu,铜-铁-稀硫酸形成原电池,反应速率增大,反应用时少于b,但生成的氢气少也少于b,图象应为A.
故选A.
本题解析:
本题难度:简单
5、选择题 一定量的盐酸跟少量的铁粉反应,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入( )
A.KNO3溶液
B.NaCl溶液
C.锡粉
D.硫酸
参考答案:A、加入KNO3溶液,酸性条件下硝酸根具有强氧化性,铁与硝酸反应不能生成氢气,导致生成氢气总量减小,故A错误;
B、加入NaCl溶液,H+浓度降低,反应速率降低,不影响生成氢气的总量,故B正确;
C、加入锡粉构成原电池,反应加快,故C错误;
D、加入硫酸,如导致H+浓度增大,则反应速率加快,故D错误;
故选B.
本题解析:
本题难度:简单