微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,固定容积的密闭容器中反应:2NO2(g)  2NO(g)+O2(g)△H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
2NO(g)+O2(g)△H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
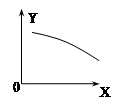
A.X表示温度时,Y表示NO2物质的量
B.X表示NO2物质的量,Y表示O2的物质的量
C.X表示反应时间时,Y表示混合气体的密度
D.X表示压强时,Y表示NO2的含量
参考答案:A
本题解析:A、升高温度,因为是吸热反应,平衡右移,正确;B、增大反应物的浓度,平衡右移,错误;C、体积不变,质量不变,密度不变,错误;D、增大压强,平衡向体积减少的方向移动,错误。
本题难度:一般
2、选择题 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)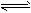 2C(g)。若经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是
[? ]
A.①③
B.①④
C.②③
D.③④
参考答案:B
本题解析:
本题难度:简单
3、填空题 (1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
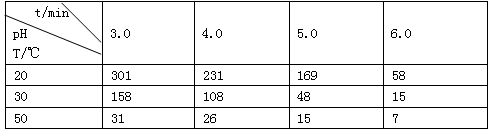
①pH增大能加速O3分解,表明对O3分解起催化作用的是_________________。
②据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填代号)
a. 40°C、pH=3.0? b. 10°C、pH=4.0? c. 30°C、pH=7.0
(2)向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生某种反应。现有两个图像分别对该反应的情况进行描述:
图1表示各物质的浓度随时间的变化情况,其中t0~t1阶段c(B)未画出;
图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件(其中t2改变的条件是加入某种催化剂);(说明:图1中实线表示反应进程)
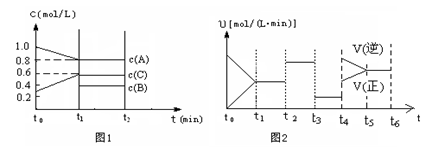
①你认为t3时改变的条件是?(填写“加压”或“减压”),B的起始物质的量为?mol;
②各阶段平衡时对应的平衡常数如下表所示:
时间段
| t1~t2
| t2~t3
| t3~t4
| t5~t6
|
平衡常数
| K1
| K2
| K3
| K4
|
用“﹥、﹤、=”符号来表达K1、K2、K3、K4之间的关系? 写此条件下该反应的热化学方程式? ________________?
(3)工业上一般采用CO(g) + 2H2(g)?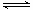 ?CH3OH(g)反应合成甲醇。
?CH3OH(g)反应合成甲醇。
下表所列数据是该反应在不同温度下的化学平衡常数的数值:
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
|
①某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率为?,此时的温度?250℃(填“>”、“<”、“=”)
②如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是?
(填“甲醇”或“氧气”),b处电极上发生的电极反应是:?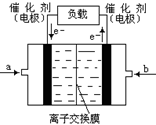
参考答案:(1)①(1分)OH-;②(2分)b a c
(2)①(1分)减压?(2分)1.0
②(1分)K1 =K2=K3 >K4
③(2分)2A(g)+B(g) 3C(g)?△H="△H=" —a?kJ·mol-1(a>0)
3C(g)?△H="△H=" —a?kJ·mol-1(a>0)
(3)①(2分)80% ,(1分)<
②氧气(1分)? CH3OH - 6e- + 8OH - ="=" CO3 2-?+?6H2O (2分)
本题解析:(1)①pH增大,说明OH-的浓度增大,这表明对O3分解起催化作用的是OH-;②50°C、pH=3.0,O3的浓度减少一半所需的时间31min,即 40°C、pH="3.0" ,O3的浓度减少一半所需的时间大于31min,而30°C、pH=6.0,O3的浓度减少一半所需的时间为15min,所以30°C、pH=6.0,O3的浓度减少一半所需的时间小于15min,故O3的分解速率按依次增大的顺序为b a c;(2)①t3时,正逆反应都同时减少,所以t3时改变的条件是减压,根据图1可以知道,A的物质的量的浓度减小了0.2mol/L,C增加了0.3mol/L,故B为反应物,且B的物质的量减少0.1mol/L,所以B起始物质的量为(0.4+0.1)×2=1.0mol,②该反应的化学方程式为
2A+B 3C,t4为升高温度所致,有图可以知道,温度升高逆反应的变化程度大于正反应的程度,所以该反应为放热反应,催化剂不可以改变化学平衡,温度不变平衡常数不变,所以K1、K2、K3、K4之间的关系为K1 =K2=K3 >K4,此条件下该反应的热化学方程式为2A(g)+B(g)
3C,t4为升高温度所致,有图可以知道,温度升高逆反应的变化程度大于正反应的程度,所以该反应为放热反应,催化剂不可以改变化学平衡,温度不变平衡常数不变,所以K1、K2、K3、K4之间的关系为K1 =K2=K3 >K4,此条件下该反应的热化学方程式为2A(g)+B(g) 3C(g)?△H= —a?kJ·mol-1(a>0);(3)①CO(g) + 2H2(g)?
3C(g)?△H= —a?kJ·mol-1(a>0);(3)①CO(g) + 2H2(g)?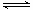 ?CH3OH(g),某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率=(1-0.1×2)/1×100%=80% ,
?CH3OH(g),某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率=(1-0.1×2)/1×100%=80% ,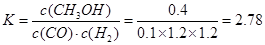 ,该反应为放热反应,因为表中的数据为温度越大,K越小,所以该温度小于250℃;②从图可以看出,电子从b流向a,所以a为正极,b为负极,即a通入的是氧气,b通入的为甲醇,b处电极上发生的电极反应是:
,该反应为放热反应,因为表中的数据为温度越大,K越小,所以该温度小于250℃;②从图可以看出,电子从b流向a,所以a为正极,b为负极,即a通入的是氧气,b通入的为甲醇,b处电极上发生的电极反应是:
CH3OH -6e- +8OH -=CO3 2-?+?6H2O。
点评:本题考查了化学平衡、原电池,该题考查的知识面比较广,综合性强,有一定的难度。
本题难度:一般
4、选择题 下列说法中可以证明反应H2(g)+I2(g)  2HI(g)已达平衡状态的是
2HI(g)已达平衡状态的是
①单位时间内生成n mol H2的同时生成n mol HI ②一个H—H键断裂的同时有两个H—I键断裂 ③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=v(HI) ⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1 ⑥温度和体积一定时,生成物浓度不再变化 ⑦温度和体积一定时,容器内的压强不再变化 ⑧条件一定时,混合气体的平均相对分子质量不再变化 ⑨温度和体积一定时,混合气体颜色不再变化 ⑩温度和压强一定时,混合气体的密度不再变化
A.①②③④
B.②⑥⑨
C.②⑥⑨⑩
D.③⑤⑥⑦⑧
参考答案:B
本题解析:对于反应前后气体分子数相等的可逆反应,平均相对分子质量、压强及密度不能用来判断反应是否达到平衡。
本题难度:简单
5、选择题 将4mol?A气体和2?mol?B气体在体积为2?L的密闭容器中混合,并在一定条件下发生如下反应:
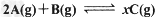 若经2?s后测得A的物质的量为2.8?mol,?C的浓度为0.6?mol/L。现有下列几种说法,其中正确的是?
若经2?s后测得A的物质的量为2.8?mol,?C的浓度为0.6?mol/L。现有下列几种说法,其中正确的是?
[? ]
①2s内用物质A表示的平均反应速率为0.3?mol/(L·s)
②2s内用物质B表示的平均反应速率为0.6?mol/(L·s)
③2s时物质B的转化率为70%
④x=2?
A.①③?
B.①④?
C.②③?
D.③④?
参考答案:B
本题解析:
本题难度:简单