微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知氮元素有许多化合价,其化合价有一3、0、+1、+2、+3、+4、+5
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:
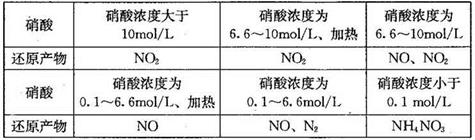
金属锌与某浓度的硝酸反应时,无气体产生,则此化学反应中被还原的硝酸与参加反应的硝酸物质的量之比是____________。
(2)以氨作为燃料的固体氧化物(含有02-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示,
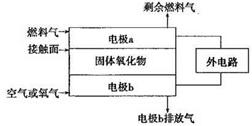
①该电池工作时的总反应为_______________________
②固体氧化物作为电池工作的电解质,O2-移动方向为________(选填“由电极a向电极b”或“由电极b向电极a”)。
③该电池工作时,在接触面上发生的电极反应为________。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。如图所示装置可用于制备N2O5,写出在电解池中生成N2O5的电极反应式________________。
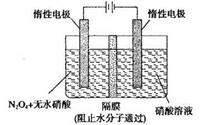
参考答案:(1)1:10? 4Zn+10HNO3(稀)=4Zn(NO3) 2+NH4NO3+3H2O。(2)4NH3+3O2=2N2+6H2O.由电极b向电极a(因为阴离子向原电池的负极移动) 2NH3+3O2-+6e-= N2+3H2O?(3)N2O4+2HNO3-2e-=2N2O5+2H+。
本题解析:(1)金属锌与某浓度的硝酸反应时,无气体产生,说明硝酸被还原产生的氨气被硝酸吸收产生了硝酸铵。反应的化学方程式为:4Zn+10HNO3(稀)=Zn(NO3) 2+NH4NO3+3H2O此化学反应中有10个HNO3参加反应,其中被还原的HNO3是1个。所以被还原的硝酸与参加反应的硝酸物质的量之比是1:10.(2)①该电池工作时的总反应为4NH3+3O2=2N2+6H2O。② 固体氧化物作为电池工作的电解质,O2-会向正电荷较多的负极方向移动。即移动方向为由电极b向电极a。③该电池工作时,在接触面上发生的电极反应为2NH3+3O2-+6e-= N2+3H2O 。(3)用电解法以N2O4和2HNO3为原料,在电解池中生成N2O5的电极反应式N2O4+2HNO3-2e-=2N2O5+2H+。
本题难度:一般
2、填空题 高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应配平后的离子方程式____________________。
(2)不同条件下高锰酸钾可发生不同如下反应:
MnO4-+5e+8H+→Mn2++4H2O? MnO4-+3e+2H2O→MnO2+4OH-?MnO4-+e→MnO42-
由此可知,高锰酸根离子(MnO4-)反应后的产物与?有关。
(3)高锰酸钾可代替二氧化锰用来制取Cl2,反应中氧化剂和还原剂物质的量之比为_____________。
(4)高锰酸钾溶液与硫化亚铁在酸性条件下发生如下反应:
10FeS + 6KMnO4 + 24H2SO4 → 3K2SO4 + 6MnSO4 + 5Fe2(SO4)3 + 10S + 24H2O
若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为?。
参考答案:(1)2MnO4-+5C2O4 2-+16H+═10CO2↑+2Mn2++8H2O
(2)溶液的酸碱性
(3)1:5
(4)0.1Na
本题解析:(1)CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,其中发生氧化反应的只有C2O42-→CO2,故能有C2O42-与MnO4- 发生反应,其反应方程式为2MnO4-+5C2O4 2-+16H+═10CO2↑+2Mn2++8H2O
(2)根据离子反应方程式可知,在酸碱条件不同下,高锰酸根反应后得到的产物不同。
(3)高锰酸钾用来制取Cl2,反应方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素所在的HCl反应物是还原剂,化合价降低的Mn元素所在的反应物KMnO4是氧化剂。其中所有Mn元素化合价降低,10原子Cl化合价升高,故氧化剂和还原剂物质的量之比为1:5。
(4)10FeS + 6KMnO4 + 24H2SO4 → 3K2SO4 + 6MnSO4 + 5Fe2(SO4)3 + 10S + 24H2O,反应物中固体为FeS,产物中固体为单质S,反应前后质量减少2.8g,根据差量法计算可知,共有0.05molFeS发生反应,故其中S元素为0.05mol。由S2-→S零价,转移电子数目为0.05mol×2=0.1mol电子。故发生电子转移的数目为.1Na。
本题难度:一般
3、选择题 a mol Cu与含b mol HNO3的溶液恰好完全反应,被还原的HNO3的物质的量一定是
A.(b-2a)mol
B.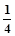 b mol
b mol
C. a mol
a mol
D.2a mol
参考答案:A
本题解析:不管硝酸的浓度如何,由铜的守恒可知,铜均被氧化为a molCu(NO3)2,而硝酸的其它部分被还原,由氮原子的守恒可知,被还原的HNO3的物质的量一定是(b-2a)mol
本题难度:一般
4、填空题 (15分)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
⑴SO2和O2反应制取SO3的反应原理为:2SO2+O2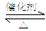 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为:?.
②该反应达到平衡状态的标志是?.
A.v(SO2)=v(SO3)? B.混合物的平均相对分子质量不变
C.混合气体质量不变? D.各组分的体积分数不变
⑵某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.
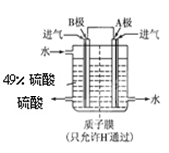 ?
?
①B电极的电极反应式为?;
②溶液中H+的移动方向由?极到?极;(用A、B表示)
⑶测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL溶液
b.量取25 mL待测液于锥形瓶中
c.用硫酸酸化的0.01 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
?Fe2++?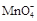 + ???——?Fe3++?Mn2++???
+ ???——?Fe3++?Mn2++???
②用硫酸酸化的KMnO4滴定终点的标志是?.
③计算上述产品中FeSO4·7H2O的质量分数为?.
参考答案:⑴① ?②BD
?②BD
⑵①SO2+2H2O-2e-==SO42-+4H+? ②B? A
⑶①5Fe2++1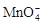 +8H+===5Fe3++1Mn2++4H2O
+8H+===5Fe3++1Mn2++4H2O
②滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色。?③0.975或97.5%
本题解析:(1)①根据平衡常数的概念可知 。
。
②A项没有正逆反应速率,不能判断;B项混合物的平均相对分子质量反应前后不同,可以判断;C项混合气体的质量反应前后不变,不能判断;D项各组分的体积分数反应前后不同,可以判断。答案选BD。
(2)①根据B极的产物可以看出B极发生氧化反应,是负极,电极方程式为SO2+2H2O-2e-=SO42-+4H+。
②阳离子向正极移动,所以H+从B极向A极移动。
(3)①根据化合价升降法,方程式配平为5Fe2++1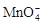 +8H+===5Fe3++1Mn2++4H2O。
+8H+===5Fe3++1Mn2++4H2O。
②KMnO4本身有颜色,所以不需要指示剂,用本身的颜色就可以判断终点,当滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色时达到滴定终点。
③产品中FeSO4·7H2O的质量分数为 。
。
点评:本题综合性强,难度较大,非常锻炼学生的思维能力。
本题难度:困难
5、选择题 取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为 (?)?
A.3.2mol/L
B.2.8mol/L
C.1.8mol/L
D.缺数据无法计算
参考答案:A
本题解析:用足量的氢气还原时发生反应:Cu2O+H2 2Cu +H2O;CuO+H2
2Cu +H2O;CuO+H2 Cu +H2O。固体减少的质量为氧元素的质量。n(O)=6.4g÷16g/mol=0.4mol.所以①n(Cu2O)+ (CuO)= n(O)=0.4mol.稀硝酸恰好完全溶解固体发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;CuO+2HNO3=Cu(NO3)2+H2O; 3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O.根据这两个反应方程式可看出:3Cu---2NO;3Cu2O—2NO。n(NO)=4.48L÷22.4L/mol=0.2mol,所以②n(Cu)+n(Cu2O)="0.3mol." ①+②可得:n(Cu)+n(CuO)+2n(Cu2O)=0.7mol.n(HNO3)=2n(Cu(NO3)2)+n(NO).而n(铜元素)=n(Cu)+n(CuO)+2n(Cu2O).所以n(HNO3)=2×0.7+0.2=1.6mol.故C(HNO3)= n(HNO3)÷V=1.6mol÷0.5L=3.2mol/L.选项为:A。2O、CuO与H2、HNO3发生化学反应的知识。
Cu +H2O。固体减少的质量为氧元素的质量。n(O)=6.4g÷16g/mol=0.4mol.所以①n(Cu2O)+ (CuO)= n(O)=0.4mol.稀硝酸恰好完全溶解固体发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;CuO+2HNO3=Cu(NO3)2+H2O; 3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O.根据这两个反应方程式可看出:3Cu---2NO;3Cu2O—2NO。n(NO)=4.48L÷22.4L/mol=0.2mol,所以②n(Cu)+n(Cu2O)="0.3mol." ①+②可得:n(Cu)+n(CuO)+2n(Cu2O)=0.7mol.n(HNO3)=2n(Cu(NO3)2)+n(NO).而n(铜元素)=n(Cu)+n(CuO)+2n(Cu2O).所以n(HNO3)=2×0.7+0.2=1.6mol.故C(HNO3)= n(HNO3)÷V=1.6mol÷0.5L=3.2mol/L.选项为:A。2O、CuO与H2、HNO3发生化学反应的知识。
本题难度:一般