微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)?△H<0 ,试回答下列问题:
CO2(g)+H2(g)?△H<0 ,试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=? ?.
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态?(填“是”与“否”),此时v(正)?v(逆)(填“大于”“小于”或“等于”),你判断的依据是?
? ?
(3)若降低温度,该反应的K值将?,该反应的化学反应速率将? ?(均填“增大”“减小”或“不变”)。
参考答案:(1)1 (2)否、大于?因为此时的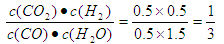 小于平衡常数1,所以正反应速率大于逆反应速率。
小于平衡常数1,所以正反应速率大于逆反应速率。
(3)增大?减小
本题解析:考查可逆反应的有关计算及外界条件对反应速率和平衡常数的影响。
(1)? CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L)? 2? 3? 0? 0
转化的浓度(mol/L)? 1.2? 1.2? 1.2? 1.2
平衡浓度(mol/L)? 0.8? 1.8? 1.2? 1.2
根据平衡常数的表达式可知K=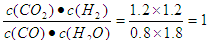
(2)? CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L)? 1? 2? 0? 0
转化的浓度(mol/L)? 0.5? 0.5? 0.5? 0.5
某时刻浓度(mol/L)? 0.5? 1.5? 0.5? 0.5
此时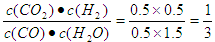 <1
<1
所以没有达到平衡状态,此时正反应速率大于逆反应速率。
(3)因为反应是放热反应,所以降低温度,平衡向正反应方向移动,因此平衡常数增大,温度反应速率减小。
本题难度:简单
2、填空题 (10分)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0?试回答下列问题:
CO2(g)+H2(g) △H<0?试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L -1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=?
-1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=?
(2)在相同温度下,起始物质按下列四种配比充入该容器中,c(H2O)=2mol·L-1,c(CO)
=c(CO2)="1" mol·L-1, c(H2)="1.5" mol·L-1,则此时该反应是否达到平衡状态?(选填“是”与“否”),此时v正?v逆(选填“ 大于”、“小于”或“等于”)。
大于”、“小于”或“等于”)。
(3)平衡时若降低温度,该反应的K值将?(选填“增 大”、“减小”或“不变”),
大”、“减小”或“不变”),
平衡?移动(选填“正向”、“逆向”或“不”)。
参考答案:(1)1?(2)否;大于?(3)增大;正向
本题解析:略
本题难度:一般
3、填空题 (19分)高炉炼铁中发生的基本反应之一如下:FeO(s)+ CO (g)  ?Fe(s)+ CO2(g)?△H>0
?Fe(s)+ CO2(g)?△H>0
(1)此反应的平衡常数表达式为:K=?;
(2)温度升高,达到新的平衡后,高炉内CO2与CO的体积比?(填“增大”、 “减小”或“不变”。);
(3)已知1100℃时,K= 0.263。某时刻测得高炉中c(CO2)= 0.025mol/L,c(CO)= 0.1mol/L,在这种情况下,该反应?(填“是”或“不是”)处于化学平衡状态。
如果“不是”,此时化学反应向?方向进行(填“正反应”或“逆反应”)。如果“是”,此空不填。
(4)在一定温度下,10L密闭容器中加入5molSO2、4.5molO2,发生反应2SO2+O2 2SO3经10min后反应达平衡时有3molSO3生成。试计算:
2SO3经10min后反应达平衡时有3molSO3生成。试计算:
①O2的转化率为:?
②平衡常数K为:?
参考答案:

本题解析:略
本题难度:简单
4、选择题 在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是
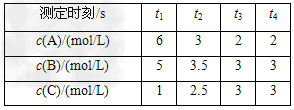
[? ]
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B 2C
2C
D.在t2~t3内A的平均反应速率为:[1/(t3-t2)]?mol/(L·s)
参考答案:D
本题解析:
本题难度:一般
5、选择题 测得某反应A+B 2C在不同温度下的平衡常数:
2C在不同温度下的平衡常数:
又测得温度t时,反应2C? A+B的平衡常数为0.05,可推知t的范围是(?)
A+B的平衡常数为0.05,可推知t的范围是(?)
A. t<500C? B. t>800C? C. 500C<t<800C? D. 无法确定
参考答案:A
本题解析:温度t时,反应2C? A+B的平衡常数为0.05,则此温度下A+B
A+B的平衡常数为0.05,则此温度下A+B 2C的平衡常数为1÷0.05=20。根据表中数据可知,温度越高,平衡常数越大,所以答案选A。
2C的平衡常数为1÷0.05=20。根据表中数据可知,温度越高,平衡常数越大,所以答案选A。
本题难度:简单