微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业上可利用合成气(CO和H2的混合气体)生产甲醇。已知:
CO(g)+2H2(g) CH3OH(g) ΔH=—92.9kJ/mo1
CH3OH(g) ΔH=—92.9kJ/mo1
一定条件下,该反应在一体积固定的密闭容器中达到平衡。下列说法正确的是
A.该反应的△S<0
B.该反应在任何温度下均能自发进行
C.向容器中充入少量He,平衡向正反应方向移动
D.升高温度平衡向正反应方向移动
2、计算题 在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s
浓度mol·L-1
| 0
| 20
| 40
| 60
| 80
| 100
|
c(N2O4)mol·L-1
| 0.100
| c1
| 0.050
| c3
| a
| b
|
c(NO2)/mol·L-1
| 0.000
| 0.060
| c2
| 0.120
| 0.120
| 0.120
|
试填空:
(1)达到平衡时N2O4的转化 率为?%,表中c2?c3,a ?b (选填“>”“<”“=”)。
(2)20s的四氧化二氮的浓度c1=?mol·L-1,在0s~20s内四氧化二氮的平均反应速率为?mol·(L·s)-1;。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是?mol·L-1。
3、填空题 (每空2分共10分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。若把体系温度降至800℃求得平衡常数K1=0.81,可以推知该反应的正反应为__________反应(填“吸热”、“放热”)。
(2)800℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应?进行.(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
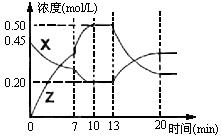
(1)0~10min 容器内气体的压强逐渐? ___________。(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是? ___第13min时曲线变化的原因可能是? __(填序号)
①增加Z的量? ②增加X的量? ③升温? ④降温? ⑤使用催化剂
4、计算题 (7分)在0.1L密闭容器中有0.1molSO2和0.05molO2发生反应,恒温下30min后达到平衡。
(1)若得到0.06molSO3,求达平衡时SO2的浓度;
(2)求30min内的反应速率:v(SO3)、v(O2)、v(SO2)。
(3)求平衡时气体压强与开始时气体压强之比。
5、选择题 能用勒夏特列原理解释的是(?)?
A.红棕色的NO2,加压后颜色先变深后变浅
B.工业上合成NH3反应使用催化剂
C.实验室可以采用排饱和食盐水收集Cl2
D.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深