微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (9分)实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
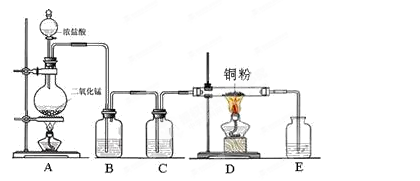
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况?。
(2)C处盛放的试剂?(填名称),其作用是?。
(3)E处盛有?(填名称),发生反应的离子方程式为?。
(4)实验结束时,应先熄灭?处酒精灯。
参考答案:(9分) (3分)
(3分)
(2)浓硫酸(1分)?干燥气体(1分)(3)氢氧化钠(1分)? 2OH-+Cl2=Cl-+ClO-+H2O?(2分)?
(4)D(防止倒吸)(1分)
本题解析:(1)A装置是生成氯气的,实验室用二氧化锰氧化浓盐酸生成氯气,其中二氧化锰是氧化剂,氯化氢是还原剂,反应中转移2个电子,方程式为 。
。
(2)由于和铜反应的氯气应该是纯净干燥的,所以B中盛有饱和食盐水,除去氯化氢。C中盛有浓硫酸,干燥氯气。
(3)氯气有毒,需要尾气处理装置,可用氢氧化钠吸收多于的氯气,方程式为2OH-+Cl2=Cl-+ClO-+H2O?。
(4)实验结束时,应先熄灭D处酒精灯,以防止倒吸。
本题难度:一般
2、实验题 (17分)
(1)右图所示是实验室中制取气体的一种简易装置。

①请简述检验它的气密性的方法?。
②利用右图所示装置可以制取?气体(填反应物状况及发生反应是否需要的条件)。
(2)张明同学设计下图所示装置,用粗铁粒与189g·L-1硝酸反应制取NO气体。请回答有关问题。

①189g·L-1硝酸的物质的量浓度为?。
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是?。
③当找末止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是?。B装置烧杯中液体的作用是?。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
④该实验中,若去掉B装置,对实验结果是否有影响??。
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后 www.91eXam.orgFe和HNO3均无剩余,则反应中转移电子的物质的量是?(用含a和b的代数式表示)。
⑥完全反应后,A装置烧杯里含铁的价态可能是?。现有仪器和药品:试管和胶头滴管。0.1mol·L-1KSCN溶液、0.1mol·L-1KI溶液、0.2mol·L-1酸性KMnO4溶液、氯水等。请你设计一个简单实验,探究上述判断,填写下列实验报告:
实验步骤
| 操作
| 现象与结论
|
第一步
| 取少量液体装于试管,向试管中滴入几滴KSCN溶液
| ?
|
第二步
| ?
| 若溶液紫色退去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+
参考答案:(1)关闭止水夹B,从A处加入水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好(2分。没有关闭止水夹B不得分)?
②块状或较大颗粒状固体与液体不需要加热反应生-成的(2分。只答固体扣1分,不说明条件扣1分)
(2)① 3mol·L-1(2分。漏单位扣1分)
②NO与空气中的O2反应;NO与空气密度接近(2分)
③有红棕色气体出现(1分)吸收NO2(1分)
④无影响(1分)?
⑤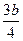 mol(2a mol或3amol或2amol~3amol) mol(2a mol或3amol或2amol~3amol)
(2分。用含a的代数式表达时,答不全得1分)
⑥ +2价或+3价或+2价和+3价(2分。答不全得1分)
若溶液变血红色,说明含Fe3+,若溶液无明显变化,说明不含Fe3+(1分)
取少量液体装于试管,向试管-中滴入几滴酸性KMnO4溶液(1分)
本题解析:略
本题难度:一般
3、填空题 (10分) 下图是实验室中制备气体或验 证气体性质的装置图 证气体性质的装置图
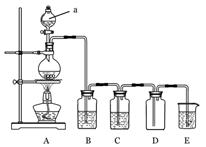
(1)仪器a的名称是_________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为_______________________________________。
②装置B中的溶液为__________________________;
烧杯中溶液的作用为________________ 。 。
(3)利用上图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。
圆底烧瓶内加入碳,a中加入浓硫酸,B、D中匀为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2具有漂白性的装置是?,现象是??
②证明SO2具有还原性的现象是???
③证明生成气体中含有CO2的现象是?
④D装置的作用是?。
参考答案:(1)分液漏斗。(1分)
(2)①MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O。(2分)
②饱和NaCl溶液(1分);?吸收氯气防污染 。(1分) 。(1分)
(3)①B(1分)?品红褪色(1分)
②C中KMnO4溶液褪色?(1分)
③D中品红不褪色且石灰水变浑浊(1分)
④检验SO2是否除尽(1分)
本题解析:略
本题难度:一般
4、实验题 欲在室温和1.01×105Pa条件下测定镁的原子量。请利用图给定的仪器(盛放镁条的隔板有小孔)组装成一套实验装置(每种仪器只允许用一次)。

请回答下列问题:
(1)假设气流方向为左→右,则各仪器的接口连接的先后顺序为(用小写字母填写)______。
(2)连接好仪器后,要进行的操作有以下几步:① 待仪器B中的物质恢复至室温时,测量量简C中水的体积(若假定将测定的体积换算成标准状况下为VmL);② 擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为mg),并将其投入试管B中;③ 检查各装置的气密性;④ 旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞。上述几步操作的先后顺序是______。
(3)根据实验数据可算出镁的相对原子质量,其数字表达式为________。
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量数据(填偏高、偏低或无影响)________。
(5)若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量数据(填偏高、偏低或无影响)_________。
参考答案:(1)a接h、g接b、c接f、e接d
(2)②③④①或③②④①
(3)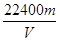
(4)偏低
(5)偏高
本题解析:
【错解分析】本题考查为实现某定量测定目标设计、组装仪器和操作程序的能力,以及依据实验原理判断实验误差的能力。
【正解】本题测定镁的相对原子质量的实验原理是根据已称量的mg镁产生H2的体积,来计算镁的相对原子质量。根据题目给的装置,完成此实验必须做到以下两点:一是镁跟盐酸反应要充分;二是用排水法准确量得产生H2的体积。
为此,仪器的连接顺序应为:a接h、g接b、c接f、e接d,最终使产生的H2将D中的水排入量筒中,可测得H2的体积。
根据Mg与HCl反应不难确定(设镁的相对原子质量为A):
Mg——H2
A? 22400
m? V
A=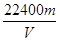
实验误差的讨论应依据上式:若B试管未冷却至室温,H2体积偏大,会造成计算结果镁原子量偏低;若镁条表面氧化膜未擦净,称量时将MgO的质量计在镁的质量上,实际收集到H2体积偏小,计算结果的相对原子质量偏高。
本题难度:一般
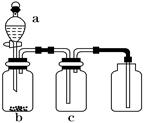
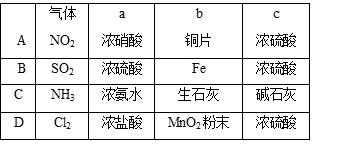
5、选择题 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的
试剂),其中可行的是?
 ? ?
参考答案:A
本题解析:B错误,因为铁在浓硫酸会钝化,不能用来制备二氧化硫;C错误,因为氨气的密度比空气小,不能采用向上拍空气法的方法收集;D错误,因为采用浓盐酸与二氧化锰反应制备氯气需要加热,所以答案为A。
点评:本题考查了具体气体的制备装置的选择,是高考考查的热点,本题有一定的综合性,难度适中。
本题难度:简单
|