|
高考化学知识点总结《离子共存》答题技巧(2017年最新版)(四)
2017-03-02 23:10:03
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室需配制一种溶液,除水电离出的离子外还含有五种离子,且在该溶液中这五种离子的物质的量浓度均为l mol·L-1,下面四个选项中,能达到此要求的是
A.Al3+、K+、SO42-、Cl-、HCO3-
B.Fe2+、H+、Br-、NO3—、Cl-
C.Na+、K+、SO42-、NO3—、Cl-
D.Al3+、Na+、Cl-、SO42-、NO3—
|
参考答案:D
本题解析:A.Al3+与HCO3-水解相互促进,不能大量共存,A错误; B.在酸性溶液中Fe2+、Br-均能被NO3—氧化,不能大量共存,B错误;C.根据电荷守恒可知,c(Na+)+c(K+)≠2c(SO42-)+c(Cl-)+c(NO3—),C错误;D.Al3+、Na+、Cl-、SO42-、NO3—之间不反应,且满足电荷守恒,D正确,答案选D。
考点:考查
本题难度:一般
2、填空题 某透明溶液,可能含有(大量存在)下面离子的几种:(阳离子组:Cu2+、Ba2+、Mg2+、H+;阴离子组:Cl-、OH-、N 、C),已知该溶液能和铝粉反应放出氢气.
(1)如果确定该溶液中含有Mg2+,试推断溶液中一定还含有______离子.
(2)如果确定该溶液中含有OH-,则溶液中一定还含有______.
参考答案:溶液能和铝粉反应放出氢气,为酸或强碱溶液,
(1)该溶液中含有Mg2+,该溶液为酸溶液,一定存在H+,因H+与OH-结合生成水,与NO3- 结合具有强氧化性不生成氢气,与CO32-结合生成水和气体,则不能共存,又溶液不显电性,一定存在阴离子,则一定有Cl-,故答案为:H+、Cl-;
(2)该溶液中含有OH-,该溶液为强碱溶液,OH-能分别与Cu2+、Mg2+、H+反应,则一定存在Ba2+,故答案为:Ba2+.
本题解析:
本题难度:一般
3、选择题 下列各组离子,在指定的环境中一定能大量共存的是( )
A.在pH为7的溶液中:Ag+、K+、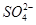 、Cl- 、Cl-
B.在能使pH试纸变深蓝色的溶液中:Na+、S2-、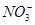 、 、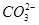
C.在加入铝粉能产生H2的溶液中: 、Fe2+、 、Fe2+、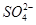 、 、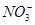
D.在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Mg2+、Cl-、I-
参考答案:B
本题解析:A中Ag+、Cl-不能大量共存,C中铝粉能产生H2的溶液中,溶液或酸性或碱性,如果溶液呈酸性,则Fe2+、NO3-不能大量共存,D中水电离出的c(OH-)=10-13mol·L-1的溶液中,溶液或酸性或碱性,如果溶液呈碱性,则Mg2+不能大量共存。所以选B。
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与 CO32-、HCO3-、AlO2-、ClO-,S2-等);(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(5)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:一般
4、选择题 在一含Na+的澄清溶液中,可能还存在NH4+.Fe2+.I-.Br-.CO32-.SO32-六种离子中的几种:①在原来溶液中滴加足量的饱和氯水,有气泡生成,溶液呈现橙黄色。②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成。 ③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,下列说法不正确的是
A.溶液中一定存在Br-、CO32-
B.溶液中可能存在NH4+
C.溶液中一定不存在Fe2+、I-、SO32-
D.溶液一定呈碱性
参考答案:D
本题解析:①在原溶液中滴加足量的饱和氯水后,有气泡生成,说明溶液中含有CO32-,则一定不存在Fe2+,溶液呈橙黄色,说明可能生成I2或Br2;
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,说明不含SO32-;
③橙黄色溶液不能使淀粉溶液变蓝色,说明不含I-.
所以溶液中一定不存在Fe2+、I-、SO32-,
一定存在Br-、CO32-,
由于没有涉及到NH4+离子的性质,则NH4+不能确定是否存在,
如溶液中存在大量的NH4+,则溶液呈酸性.
故选D。
点评:本题考查离子的检验,题目难度不大,注意通过反应的现象结合离子的性质进行推断,要排除实验操作的干扰。
本题难度:一般
5、选择题 某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是(? )
A.K+、Na+、HCO3-、NO3-
B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3-
D.Ag+、K+、NO3-、Na+
参考答案:B
本题解析:某溶液既能溶解Al(OH)3,又能溶解H2SiO3,所以该溶液一定显碱性。则HCO3-、H+、Mg2+、Ag+等均不能大量共存,答案选B。
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:一般
|