微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (9分)将0.1mol的镁铝混合物溶于100mL 2 mol·L-1的H2SO4中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
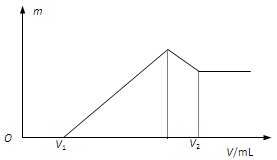
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=160mL时,则金属粉末中,n(Mg)=_______mol,V2=_______mL。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V (NaOH)=_______mL。
参考答案:(1)0.06? 440?(2)400
本题解析:(1)根据图像可知硫酸是过量的,当V1=160mL时,和金属反应的硫酸是0.2mol-0.16mol÷2=0.12mol,。设混合物中镁和铝的物质的量分别是x、y,则x+y=0.1mol、x+1.5y=0.12mol,解得y=0.04mol,x=0.06mol。所以和氯化镁、氯化铝反应消耗的氢氧化钠分别是0.12mol和0.12mol,而溶解氢氧化铝消耗的氢氧化钠是0.04mol,共计0.28mol,需要氢氧化钠溶液的体积是280ml,所以V2=160ml+280ml=440ml。
(2)根据(1)可知,要生成的沉淀最多,需要氢氧化钠溶液的体积是400ml。
本题难度:一般
2、选择题 下列说法中,正确的是(?)
A.在标准状况下,1 mol水的体积约为22.4 L
B.1 mol氢气在0 ℃和3.03×105 Pa时所占的体积一定比22.4 L小
C.1 mol氮气在压强一定时,50 ℃的体积比20 ℃的小
D.1×105 Pa,25 ℃时,17g氨气的体积恰好是22.4 L
参考答案:B
本题解析:有关气体摩尔体积的考查是高考的热点。A错,因为此时水为液态。B对,因为这时压强比标准状况下压强大,所以体积减小。C错,因为压强一定,分子数一定,则温度越高,气体体积越大。D错,该条件不是标准状况。
本题难度:简单
3、选择题 下列各组物质所含原子数目一定相同的是
[? ]
A.10g H2O和10g NH3?
B.0.1mol CO和标准状况下2.24LCl2
C.22gCO2和标准状况下11.2L N2
D.11.2LO2和11.2L N2
参考答案:B
本题解析:
本题难度:简单
4、选择题 欲用浓硫酸配制450mL0.50mol/L的硫酸溶液.下列说法正确的是( )
A.主要玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶
B.定容时俯视容量瓶的刻度线会导致所配制的溶液浓度偏低
C.量取浓硫酸后用蒸馏水把量筒洗涤2至3次,然后把洗涤液倒入容量瓶导致所配制的溶液浓度偏高
D.摇匀后,发现液面低于容量瓶刻度线后继续加水至凹液面与刻度线相切导致所配制的溶液浓度偏高
参考答案:A.实验室没有450mL容量瓶,需要选用500mL容量瓶,故A错误;
B.定容时俯视容量瓶体积偏小,浓度偏大,故B错误;
C.量筒不需要洗涤,洗涤会使溶质的物质的量增大,浓度偏高,故C正确;
D.继续加水至凹液面与刻度线相切,使溶液体积偏大,浓度偏小,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值,下列说法正确的是(?)
A.常温常压下,17g甲基(—14CH3)所含的中子数为9NA
B.pH=1的稀硫酸中含有的H+ 数为0.1NA
C.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
D.常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA
参考答案:D
本题解析:A中,甲基(—14CH3)的质量数A为17,质子数Z = 6+3×1 = 9,故中子数N = A-Z = 8,因此17g甲基(—14CH3)所含的中子数为8NA,该选项错误;B中没有注明稀硫酸的体积,故不能计算H+ 数,只能写做c(H+ ) = 0.1mol/L,该选项错误;C中Cl2只部分溶于水,故转移电子数小于0.1NA,该选项错误;D中, pH=12,OH-浓度为0.01mol/L,故20 L含有的OH-离子数为0.2NA,该选项正确。
点评:本题涉及了阿伏伽德罗常数的计算,需要学生对这方面的公式和计算方法熟练掌握,细节方面注意对分子,原子,离子的概念辨析。
本题难度:一般