微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一种新型火箭燃料1,3,3-三硝基氮杂环丁烷(TNAZ)的结构如图所示。下列有关TNAZ的说法正确的是
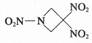
A.分子中N、O间形成的共价键是非极性键
B.该物质既有氧化性又有还原性
C.C、N、O的第一电离能从大到小的顺序为O>N>C
D.C、N、0的气态氢化物的沸点依次降低
参考答案:B
本题解析:
正确答案:B
A.不正确,分子中N、O间形成的共价键是极性键,成键两原子不同。
B.正确,该物质既有氧化性又有还原性
C.不正确,N的2P能级上处于半充滿状态,C、N、O的第一电离能从大到小的顺序为N>O> C
D.不正确,C、N、0的气态氢化物的沸点依次升高。
本题难度:简单
2、选择题 同周期的X、Y、Z三种元素,常温下它们的气态氢化物的化学式为H2X、YH3、ZH4,下列说法正确的是(?)
A.气态氢化物的稳定性按X、Y、Z的顺序递减
B.三种元素的含氧酸酸性:H4ZO4 > H3YO4> H2XO4
C.元素的最高正价按X、Y、Z的顺序递减
D.元素原子的半径按X、Y、Z的顺序递减
参考答案:AC
本题解析:气态氢化物中氢元素显+1价,则X、Y、Z的最低负价分别为—2、—3、—4,由于最低负价=主族序数—8(除氢外),则X、Y、Z分别位于同周期的第VIA、VA、IVA族,非金属性:X>Y>Z,则气态氢化物的稳定性:H2X>YH3>ZH4,故A正确;非金属行越强,最高价氧化物对应水化物酸性越强,则酸性:H4ZO4 < H3YO4< H2XO4,故B错;X、Y、Z的最低负价分别为—2、—3、—4,由于主族元素的最高正价=最低负价+8(除氢外),则X、Y、Z的最高正价分别为+6、+5、+4,故C正确;X、Y、Z的原子序数逐渐减小,同周期主族元素的原子序数越大,其原子半径越小,则X、Y、Z的原子半径逐渐增大,故D错。
本题难度:一般
3、选择题 下列说法正确的是
A.元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,共16纵行
B.X2+的核外电子数目为18,则X在第四周期第ⅡA族
C.Li是最活泼金属,F是最活泼非金属
D.NaOH碱性比KOH强
参考答案:B
本题解析:
元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,但第Ⅷ族有三个纵行,所以元素周期表共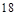 纵行,A错;
纵行,A错;
X2+的核外电子数目为18,则其原子序数为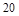 ,是
,是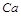 元素,在第四周期第ⅡA族,故B正确;
元素,在第四周期第ⅡA族,故B正确;
F元素的最外层有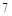 外电子,原子核对电子的引力很大,极易得到
外电子,原子核对电子的引力很大,极易得到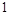 个电子达到最外层
个电子达到最外层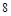 个电子的稳定结构,是最活泼非金属.碱金属随着核电核数的增加,原子半径逐渐增大,还原性增强,金属活性越来越强,所以Li不是最活泼金属,;故C错
个电子的稳定结构,是最活泼非金属.碱金属随着核电核数的增加,原子半径逐渐增大,还原性增强,金属活性越来越强,所以Li不是最活泼金属,;故C错
碱金属随着核电核数的增加,原子半径逐渐增大,还原性增强,金属活性越来越强,所以碱性逐渐增强,故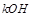 碱性比
碱性比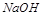 强,故D错
强,故D错
故正确答案为B
本题难度:一般
4、选择题 某元素的原子核外有3个电子层,最外层有7个电子,其核内的质子数为
A.14
B.15
C.16
D.17
参考答案:D
本题解析:考查原子核外电子的排布规律。由于K、L层分别容纳的电子是2和8,所以质子数等于17,答案选D。
本题难度:简单
5、选择题 X、Y、Z是原子序数依次增大且属于不同周期的三种常见短周期元素,三种元素相互之间可以形成1︰1型的化合物M、N、R,常温下M、N为固体,R为液体。M、N遇到水都能产生气体,而且产生的气体相互可以化合,下列说法正确的是
A.R中有极性共价键和非极性共价键
B.Z是地壳中含量最多的元素
C.三种化合物都是共价化合物
D.M、N投入水中所得溶液中溶质相同
参考答案:AD
本题解析:很容易知道X元素为氢元素,它可和第二周期的氧元素形成双氧水,又可和第三周期的钠元素形成NaH。而Na和O对应的物质的过氧化钠,即Y元素为氧,Z元素为钠
A:双氧水H2O2含有一个非极性过氧键和两个极性H—O键
B:铝是地壳中含量最大的元素
C:双氧水为共价化合物
D:NaH+H2O=NaOH+H2↑? 2Na2O2+2CO2=2Na2CO3+O2↑
本题难度:一般