微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能使水的电离平衡向电离方向移动,而且溶液呈酸性的是( )
A.加热
B.加少量稀盐酸
C.加少量稀NaOH溶液
D.加少量三氯化铁溶液
参考答案:D
本题解析:
本题难度:简单
2、选择题 高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
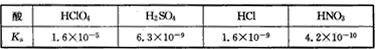
从以上表格中判断下列说法正确的是?
[? ]
A.在冰醋酸和水中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4==2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列关于电解质溶液的叙述正确的是
A.常温下物质的量浓度相等①NH4HSO4、②(NH4)2SO4、③(NH4)2CO3三种溶液中c(NH4+) ①<②<③
B.在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
参考答案:D
本题解析:磷酸氢铵能电离出氢离子,抑制NH4+水解,碳酸铵中CO32-水解促进NH4+水解,所以c(NH4+)应该是①<③<②,A不正确;硫酸铵水解促进水的电离,B不正确;醋酸是弱酸,在pH相等的条件小,醋酸的浓度大,消耗的氢氧化钠多,C不正确;硫化钠的水解程度大于NaHS的水解程度,所以D正确,答案选D。
本题难度:简单
4、选择题 下列说法正确的是?
[? ]
A.0.1?mol/L氨水与0.1?mol/L盐酸等体积混合,所得溶液中c(H+)=c(OH-) ?
B.100?℃时,纯水中c(H+)=1×10-6?mol/L,此时纯水显酸性 ?
C.25℃时,将pH=a的醋酸溶液稀释10倍后,溶液的pH=b,则a>b ?
D.25℃时, =0.1?mol/L的溶液中,Na+、CO32-、Cl-一定能大量共存
=0.1?mol/L的溶液中,Na+、CO32-、Cl-一定能大量共存
参考答案:D
本题解析:
本题难度:一般
5、选择题 在甲酸的下列性质中,可以证明它是弱电解质的是
A.1mol/L的甲酸溶液中c(H+)约为1×10-2 mol/L
B.甲酸能与水以任意比例互溶
C.1mol/L的甲酸溶液10mL恰好与10mL1mol/L的NaOH溶液完全反应
D.甲酸溶液的导电性比盐酸弱