微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 PH=3的盐酸和醋酸各100mL,分别和锌反应,反应完后,放出的气体一样多。若最后有一溶液中锌剩余,则下列判断正确的是? (? )?
A.反应开始时速率v(HCl)> v(CH3COOH)
B.加入的锌质量相等
C.盐酸中锌有剩余
D.反应开始后不久,醋酸反应的速率小于盐酸
参考答案:C
本题解析:略
本题难度:一般
2、选择题 已知25℃时有关弱酸的电离平衡常数.下列选项错误的是
| 弱酸 | HCOOH | HCN | H2CO3
电离平衡常数
1.77×10-5
4.9×10-10
Ki1=4.3×10-7Ki2=5.6×10-11
|
( )
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(NaHCO3)>pH(HCOONa)
B.2CN-+H2O+CO2→HCN+CO32-
C.等物质的量浓度的HCN溶液与NaOH溶液等体积混合后溶液中:c(OH-)>c(H+),c(Na+)>c(CN-)
D.NaHCO3和Na2CO3混合液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
参考答案:A、由电离常数Ka的关系可知,1.77×10-5>4.3×10-7>4.9×10-10>5.6×10-11,则酸性HCOOH>H2CO3>HCN>HCO3-,显然等浓度时Na2CO3的水解程度最大,其溶液的pH最大,则等物质的量浓度的各溶液pH关系为pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(HCOONa),故A错误;
B、氢氰酸的酸性大于碳酸氢根离子而小于碳酸,所以发生CN-+H2O+CO2→HCN+HCO3-反应,故B错误;
C、等物质的量浓度的HCN溶液与NaOH溶液等体积混合后反应生成NaCN,CN-水解溶液显碱性,所以c(OH-)>c(H+),c(Na+)>c(CN-),故C正确;
D、因溶液不显电性,则所有阳离子带的电荷总数等于阴离子带的负电荷总数,即c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确;
故选AB.
本题解析:
本题难度:一般
3、填空题 已知:
酸
| 电离常数(Ka)
| 酸
| 电离常数(Ka)
|
CH3COOH
| 1.8×10-5
| HCN
| 5×10-10
|
H2CO3
| Ka1 =" " 4.2×10-7
| HClO
| 3×10-8
|
Ka2 =" " 5.6×10-11
|
(1)用方程式表示HCN溶液显酸性的原因:______________________________。
(2)上述四种酸中,酸性最强的是 ;
(3)25℃时,0.01 mol/L NaCN溶液的pH________7;
(4)在浓度均为0.01 mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01 mol/L HCl,则体系中酸根离子反应的先后顺序为 ;
(5)向pH=4的CH3COOH溶液中,加入下列物质,能使CH3COOH电离平衡向逆向移动的是:_________________。
①加入少量NH4Cl固体 ②加入等体积pH=5的盐酸
③加入少量Na2CO3固体 ④加入等体积0.01 mol/L的CH3COONa 溶液
参考答案:(1)HCN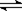 H++CN— (2)CH3COOH; (3)>;
H++CN— (2)CH3COOH; (3)>;
(4)CO32—、ClO—、HCO3—、CH3COO— (5) ①④
本题解析:
试题分析:(1)HCN是弱电解,部分电离,故答案为:HCN?H++CN-;(2)电离常数越大,溶液的酸性越强,即醋酸的酸性最强,故答案为CH3COOH;(3)NaCN是强碱弱酸盐水解呈碱性,故答案为>;(4)酸根离子对应酸的酸性越弱,越容易结合氢离子,故答案为CO32—、ClO—、HCO3—、CH3COO— ;(5)醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,①加入氯化铵,水解显酸性,平衡向逆反应方向进行;②加入pH=5的盐酸,氢离子浓度小于醋酸中的氢离子浓度,即醋酸中氢离子浓度减小,平衡向正反应方向移动;③加入碳酸钠固体,碳酸根离子和氢离子反应而使氢离子浓度减小,则促进醋酸电离,平衡正向移动;④加入少量CH3COONa,溶液中CH3COO-增大,抑制醋酸电离,则平衡逆向移动,故答案为①④
考点:弱电解质在水溶液中的电离平衡
本题难度:困难
4、选择题 钠与下列物质反应都能够产生氢气:①H2O;②CH3COOH;③CH3CH2OH。从产生氢气的剧烈程度可推断出这三种物质产生H+的难易程度是(从难到易的顺序)
[? ]
A.①②③
B.②③①
C.③①②
D.②①③
参考答案:C
本题解析:
本题难度:一般
5、选择题 pH相同的盐酸和醋酸两种溶液,它们的( )
A.H+的物质的量相同
B.物质的量浓度相同
C.H+的物质的量浓度不同
D.H+的物质的量浓度相同
参考答案:D
本题解析:
本题难度:一般