微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列生活或生产中的事实不能用化学反应速率的有关原理解释的是
A.有些药物的标签上注明必须冷藏
B.铵态氮肥与草木灰不能同时施用
C.在接触室中加入五氧化二钒使二氧化硫与氧气在其表面反应
D.劈碎的木材燃烧更旺
参考答案:B
本题解析:考查外界条件对反应速率的影响。A是温度的影响,C是催化剂的影响,D是反应物的接触面积。B中是盐类的水解相互促进,答案选B。
本题难度:简单
2、选择题 Fenton试剂常用于氧化降解有机污染物X。在一定条件下.反应初始时c(X)=2.0×10-3 mol·L-1,反应10 min进行测定,得图1和图2。下列说法不正确的是

A.50oC,PH在3~6之间,X降解率随PH增大而减小
B.PH=2,温度在40~80 oC,X降解率温度升高而增大
C.无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80 oC
D.PH=2、温度为50oC,10min内v(X)=1.44x10-4 mol·L-1min-1
参考答案:C
本题解析:A、根据图1可知50oC,PH在3~6之间,X降解率随PH增大而减小,正确;B、根据图2知PH=2,温度在40~80 oC,X降解率温度升高而增大,正确;C、Fenton法的原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分,温度高双氧水易分解,错误;D、PH=2、温度为50oC,X转化率为0.72,10min内v(X)= 2.0×10-3×0.72÷10=1.44x10-4 mol·L-1min-1,正确。
本题难度:一般
3、填空题 某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
| 时间(min) | 1 | 2 | 3 | 4 | 5
氢气体积(mL)
50
120
232
290
310
|
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大?,原因是?.
(2)哪一段时段的反应速率最小?,原因是?.
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)?.
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液:
A.蒸馏水?B.NaCl溶液?C.Na2CO3溶液?D.CuSO4溶液
你认为可行的是(填编号)?.
参考答案:0~1 min、1~2 min、2~3 min、3~4 min、4~5min,各时间段的气体体积分别为:50 mL、70mL、112 mL、58 mL、20 mL,
(1)、相同通条件下,反应速率越大,相同时间内收集的气体越多;过计算得,反应速率最大的时间段是2~3 min,;原因是:该反应是放热反应,温度越高,反应速率越大.
故答案为:2~3 min;该反应是放热反应,温度升高,反应速率加快.
(2)相同通条件下,反应速率越小,相同时间内收集的气体越少;过计算得,反应速率最小的时间段是:4~5min;原因是:随着反应的进行,盐酸的浓度在减小,浓度越小,反应速率越慢.
故答案为:4~5min;盐酸的浓度减小,反应速率减慢.
(3)2~3 min生成氢气的体积是112 mL,设需要盐酸的物质的量为xmol,
?Zn+2HCl=ZnCl2 +H2 ↑?
2?mol? 22.4L
?xmol?0.112L
? x=0.01?
所以v(HCl?)=△nV△t=0.01mol0.1L1min=0.1mol/L.min
故答案为:0.1mol/(L.min)
(4)改变化学反应速率的方法有:改变溶液的浓度、改变溶液的温度、改变固体的表面积等.
A.加蒸馏水,溶液的体积增大,浓度降低,反应速率减小,但生成的气体的量不变,故A正确.
?B.加NaCl溶液,溶液的体积增大,浓度降低,反应速率减小,但生成的气体的量不变,故B正确.
?C.加Na2CO3溶液,溶液的体积增大,盐酸的浓度降低,但盐酸和碳酸钠反应生成二氧化碳,氢气的量减小,故C错误.
?D.加CuSO4溶液,能形成铜锌原电池,加快反应速率,故D错误.
故选:AB
本题解析:
本题难度:一般
4、选择题 四个体积相同的密闭容器中,在一定条件下发生反应:N2+3H2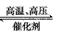 2NH3,反应开始时,反应速率最大的是
2NH3,反应开始时,反应速率最大的是
[? ]
温度(℃)?
N2 (mol)
H2(mol)
?催化剂
A.
500
2
6
有
B.
500?
1.5
4.5
无
C.
450?
1.5
4.5
无
D.
450?
2
6
无
参考答案:A
本题解析:
本题难度:一般
5、选择题 过量的锌粉跟100mL 6mol/L H2SO4反应,在一定温度下,为了减缓反应速率但又不影响生成氢气的总量。加入下列物质不能达到上述目的的是(?)
A.把锌粉改为锌粒
B.水
C.Na2CO3固体
D.降低反应体系温度
参考答案:C
本题解析:锌过量,产生氢气的速率决定于氢离子浓度,产生氢气总量决定于硫酸物质的量。锌粉改为锌粒,金属与酸接触面积减小,反应速率减小,但氢气总量不变,A正确;加水稀释,硫酸浓度减小,化学反应速率减小,但硫酸物质的量不变,氢气总量不变,B正确;加碳酸钠溶液,碳酸钠与硫酸反应,氢离子浓度减小,反应速率减小,硫酸物质的量减小,氢气总量减少,C错误;降低体系温度,化学反应速率减慢,但硫酸物质的量不变,产生氢气总量不变,D正确。
点评:过量锌与硫酸反应,产生气体的速率决定于氢离子浓度,产生的氢气的总量决定于硫酸物质的量。
本题难度:一般