微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 除去下列物质中所含的杂质,选用的试剂正确的是( )
| 选项 | 物质(杂质) | 试剂
A
Al2O3(SiO2)
NaOH
B
CO2(SO2)
Na2CO3溶液
C
FeCl2溶液(FeCl3)
Fe粉
D
NaHCO3溶液(Na2CO3)
Ca(OH)2溶液
|
A.A
B.B
C.C
D.D
参考答案:A.因氧化铝与二氧化硅均与NaOH溶液反应,不能利用选择NaOH溶液来除杂,可选HF酸溶解后过滤,故A错误;
B.二氧化碳与二氧化硫均与Na2CO3溶液反应,则不能除杂,可选饱和NaHCO3溶液利用洗气法除杂,故B错误;
C.Fe不与FeCl2溶液反应,与FeCl3溶液反应生成FeCl2,除去杂质且不引入新的杂质,故C正确;
D.NaHCO3与Na2CO3均与Ca(OH)2溶液反应,则不能除杂,可通入足量的二氧化碳来除杂,故D错误;
故选C.
本题解析:
本题难度:简单
2、选择题 根据下列实验方法和现象,得出结论正确的是(?)
A.某溶液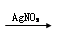 生成白色沉淀,则原溶液中一定含有Cl—
生成白色沉淀,则原溶液中一定含有Cl—
B.某溶液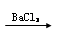 生成白色沉淀,则原溶液中一定含有SO42—
生成白色沉淀,则原溶液中一定含有SO42—
C.某溶液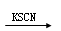 溶液呈红色,则原溶液中一定含有Fe3+
溶液呈红色,则原溶液中一定含有Fe3+
D.某溶液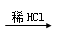 有气体产生,则原溶液中一定含有CO32—
有气体产生,则原溶液中一定含有CO32—
参考答案:C
本题解析:A.滴加硝酸银产生白色沉淀,此沉淀可能为硫酸银或碳酸银,所以原溶液中不一定含有Cl—。A错误。
B.滴加氯化钡产生白色沉淀,此沉淀可能为氯化银或碳酸钡,所以原溶液中不一定含有SO42—。B错误。
C.正确
D.滴加稀盐酸产生无色气体,此气体可能为二氧化碳或二氧化硫,则原溶液中不一定含有CO32—。D错误
点评:解决此题注意离子检验过程中实验方案的严密性。特别的有些试剂的滴加先后顺序要注意。
本题难度:一般
3、实验题 PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
?
| 熔点/℃
| 沸点/℃
| 密度/g·mL-1
| 其他
|
黄磷
| 44.1
| 280.5
| 1.82
| 2P(过量)+3Cl2 2PCl3;2P+5Cl2 2PCl3;2P+5Cl2 2PCl5 2PCl5
|
PCl3
| —112
| 75.5
| 1.574
| 遇水生成H3PO3和HCl,遇O2生成POCl3
|
POCl3
| 2
| 105.3
| 1.675
| 遇水生成H3PO4和HCl,能溶于PCl3
|
?
(一)制备:RU 图是实验室制备PCl3的装置(部分仪器已省略)
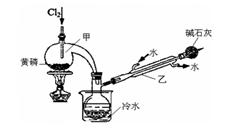
(1)仪器乙的名称____________。
(2)实验室用漂白粉加浓盐酸制备Cl2的化学方程式:_______________________ 。
(3)碱石灰的作用是____________________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一 段时间的CO2,其目的是____________________。
(二)提纯:
(5)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过_________________(填实验操作名称),即可得到PCl3的纯品。
(三)分析:
测定产品中PCl3纯度的方法如下:迅速称取4.200 g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的0.1000 mol/L 20.00? mL 碘溶液,充分反应后再用0.1000 mol/L? Na2S2O3溶液滴定过量的碘,终点时消耗10.00? mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
(6)根据上述数据,该产品中PCl3的质量分数为____________________ 。若滴定终点时俯视读数,则PCl3的质量分数_______(偏大、偏小、或无影响)
参考答案:(1)冷凝管?(2)Ca(ClO)2+4HCl = CaCl2+2H2O +2Cl2↑
(3)吸收多余的Cl2,防止污染环境; 防止空气中的水分进入,影响产品纯度。
(4)排尽装置中的空气,防止O2和水与PCl3反应
(5)蒸馏
(6)98.21%?偏大
本题解析:(1)仪器乙名称为:冷凝管;(2)实验室制备氯气用漂白粉和浓盐酸反应生成氯化钙、氯气和水,反应的化学方程式为Ca(ClO)2+4HCl = CaCl2+2H2O +2Cl2↑;(3)氯气有毒,污染空气,碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度;(4)根据题给信息知,PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,通入一段时间的CO2可以排尽装置中的空气,防止生成的PCl3与空气中的O2和水反应;(5) 由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离;(6)H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6,依据化学方程式可知H3PO3物质的量和PCl3的物质的量相同,和25ml H3PO3溶液反应的碘单质物质的量为(0.1000 mol/L×0.020L —1/2×0.1000 mol/L×0.010L)=0.0015mol,500ml溶液中PCl3的物质的量=H3PO3物质的量=碘单质物质的量为0.0015mol×20=0.03mol,PCl3质量为4.125g,该产品中PCl3的质量分数为4.125/4.20×100%=98.21%;若滴定终点时俯视读数,所读Na2S2O3溶液的体积偏小,计算剩余的碘偏小,则PCl3的质量分数偏大。
本题难度:困难
4、选择题 下列除杂质(括号中物质为杂质)所用试剂或方法不正确的是
[? ]
A.CO2(CO):O2
B.MgO?(Al2O3):NaOH溶液
C.NaHCO3溶液(Na2CO3):过量的CO2
D.CO2(HCl):饱和NaHCO3溶液
参考答案:A
本题解析:
本题难度:一般
5、选择题 在盛少量氯水的试管中加入过量的溴化钾溶液,再加少量汽油,振荡静止后(?)
A.溶液为紫色
B.汽油层呈橙色
C.汽油层呈紫红色
D.溶液为橙色
参考答案:B
本题解析:氯水将溴化钾氧化为溴,然手被汽油萃取,故为橙色。
本题难度:一般