微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 硫酸铜晶体中结晶水含量的测定实验方案中,下列情况可能造成测试结果偏高的是
①试样中含有加热不挥发的杂质 ②试样中含有加热易挥发的杂质 ③测试前试样已有部分脱水
④实验前坩埚未完全干燥 ⑤晶体加热脱水不完全 ⑥加热时晶体溅出
[? ]
A.①③④
B.②④⑤
C.②④⑥
D.①②③
参考答案:C
本题解析:
本题难度:一般
2、简答题 (1)只用一种试剂______,就可以鉴别出Na2CO3、NaOH、AgNO3、Na2S及NaNO3这五瓶无色溶液;
(2)不用任何试剂及仪器就可以确定以下各种等物质的量浓度的溶液中pH由小到大的顺序,其顺序是______;
A、NaClB、CH3COONaC、NaHSO4D、Na2CO3E、NaClO
(3)今有①CH3COOH、②HCl、③H2SO4三种溶液,用序号回答下列问题:当它们pH相同时,其物质的量浓度由大到小的排列是______;当它们的物质的量浓度相同时,其pH由大到小的排列是______;中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为______.
参考答案:(1)Na2CO3、NaOH、AgNO3、Na2S及NaNO3五瓶无色溶液,可以使用氯化铁溶液进行鉴别:碳酸钠与氯化铁反应生成红褐色沉淀和气体、氢氧化钠与氯化铁生成红褐色沉淀、硝酸银与氯化铁生成白色沉淀、硫化钠与氯化铁溶液反应生成硫单质,且氯化铁溶液褪色、硝酸钠与氯化铁溶液没有明显现象,
故答案为:FeCl3(aq);
(2)A、NaCl B、CH3COONa C、NaHSO4D、Na2CO3E、NaClO中,显示酸性的有:C、NaHSO4;显示中性的为:A、NaCl;显示碱性的为:B、CH3COONa、D、Na2CO3 E、NaClO;显示碱性的三种物质都为强碱弱酸盐,根据“越弱越水解”可知,水解程度增大,碱性最强的为D、Na2CO3 ,其次为E、NaClO,水解程度最小,碱性最弱的是B、CH3COONa,所以各溶液的pH大小关系为:C<A<B<E<D,
故答案为:C<A<B<E<D;
(3)①CH3COOH、②HCl、③H2SO4三种溶液,当它们pH相同时,要求溶液中氢离子浓度相同,醋酸为弱电解质,只能部分电离出氢离子,所以醋酸的浓度最大,其次是盐酸为一元强酸、硫酸为二元强酸,所以氯化氢浓度大于硫酸,即物质的量浓度由大到小的排列是①>②>③;
当它们的物质的量浓度相同时,溶液在氢离子浓度越大,溶液的pH越小,所以醋酸中氢离子浓度最小,溶液pH最大,其次是盐酸为一元酸,氢离子浓度小于硫酸,盐酸的pH大于硫酸,所以pH大小关系为:①>②>③;
中和同一烧碱溶液,根据中和反应实质,需要氢离子的物质的量相等,由于三种酸溶液同浓度,且醋酸、盐酸为一元酸、硫酸为二元酸,所以需要三种溶液的体积关系为:①=②=2③,
故答案为:①>②>③; ①>②>③; ①=②=2③.
本题解析:
本题难度:简单
3、简答题 海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
(1)步骤④中需用到1mol/L的稀硫酸100mL,若用98%,密度为1.84g/cm3的浓硫酸来配制,则应用量筒量取浓硫酸的体积是______.
(2)步骤③的实验操作名称是______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是______.
(3)步骤⑤中选择用苯而不用酒精来提取碘的理由是______.
(4)查阅资料:该小组同学知道海带中的碘元素主要以有机碘化物的形式存在,若该小组实验时称得海带的质量为ag,提取碘的过程中碘损失了m%,最后得到单质碘的质量为bg,该小组同学测得的海带中碘的含量为(用含a、b、m的式子表示)______.
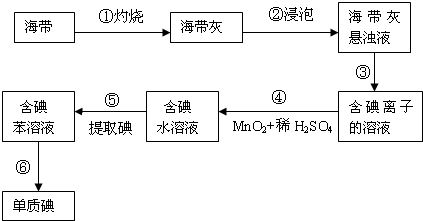
参考答案:(1)浓硫酸的物质的量浓度为103ρwM=103×1.84×98%98mol/L=18.4mol/L;设需要浓氢氧化钠溶液的体积为V,0.2mol/L×0.5L=18.4mol/L×V,V=0.0054L=5.4mL,
故答案为:5.4mL;
(2)步骤③是分离固体和液体,则实验操作为过滤,步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,是利用互溶的两种液体的沸点不同来分离,则实验操作为蒸馏,
故答案为:过滤;蒸馏;
(3)酒精与水互溶而苯不溶于水,故答案为:酒精溶于水而苯不溶于水;
(4)总的碘单质的质量为b(1-m%),则海带中碘的质量分数为100ba(1-m%)%,故答案为:ba(1-m)%或100ba(1-m%)%.
本题解析:
本题难度:一般
4、填空题 有一包白色固体,可能含有Na2CO3、KNO3、KCl、BaCl2和CuSO4,按下列步骤做实验.
①将该固体溶于水得无色溶液.
②向溶液中加入AgNO3溶液,得到白色沉淀,再加稀HNO3,白色沉淀部分溶解并有气泡产生,把气体通入澄清石灰水,石灰水变浑浊.
根据上述现象判断:
(1)一定存在的物质是______.
(2)一定不存在的物质是______.
(3)写出②中白色沉淀溶解并产生气泡的离子程式:______.
参考答案:解;根据①所得现象,溶于水得到无色溶液,确定一定无CuSO4;根据②中的现象可知生成的气体是二氧化碳,确定原固体中一定含有Na2CO3,排除BaCl2一定不存在,加入硝酸银生成白色沉淀钾硝酸部分溶解,说明原固体中含有氯离子,因为不存在BaCl2,说明一定含有KCl;KNO3不能确定;综上所述可知:
(1)一定存在的物质Na2CO3、KCl;
(2)一定不存在的物质BaCl2、CuSO4;不能确定的是KNO3;
(3)②中白色沉淀溶解并产生气泡,发生的反应是碳酸银溶解在硝酸中所以反应的离子方程式为;
Ag2CO3+2H+=2Ag++CO2↑+H2O;
故答案:
(1)Na2CO3、KCl
(2)BaCl2、CuSO4
(3)Ag2CO3+2H+=2Ag++CO2↑+H2O
本题解析:
本题难度:一般
5、实验题 已知Fe2O3与H2反应会因温度不同而可能生成Fe3O4。兴趣小组在用H2还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X。为探究X的组成,他们进行了如下实验。
(1)甲同学认为黑色粉末能被磁铁吸附,因此X是铁。但乙同学不同意他的结论,原因是__________________________________。
(2)乙同学先将少量黑色粉末X放入装有足量硫酸铜溶液的烧杯中,振荡,固体部分溶解,有极少量红色物质析出,过滤;然后向滤渣中加入盐酸,滴加几滴KSCN溶液,溶液出现红色。通过现象分析,丙同学得出X的组成是Fe和Fe3O4。
①滴加KSCN溶液的目的是__________________。
②若将粉末X直接加入盐酸中,再加KSCN溶液,溶液不出现红色,则不出现红色的原因是(用离子方程式表示)______________________。
(3)丁同学的实验方案

①操作Z是_____________________。
②通过以上数据,得出2.88 g黑色粉末X中各成分的物质的量为_______________。
参考答案:(1)Fe3O4也能被磁铁吸咐,故不能由此确定X就是铁单质
(2)①检验是否存在Fe3+,确认Fe3O4的存在;②Fe+2Fe3+===3Fe2+
(3)①过滤、洗涤;②n(Fe3O4)=0.01 mol、n(Fe)=0.01 mol
本题解析:
本题难度:困难