微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验不能达到目的的是
[? ]
?A.用氨水清洗试管内的银镜
B.用盐析的方法分离高级脂肪酸钠和甘油的混合物
C.用NaOH溶液鉴别AlCl3、MgCl2和FeCl3三种溶液
D.用饱和碳酸钠溶液除去乙酸乙酯中的乙酸
2、选择题 用下列装置不能达到有关实验目的的是
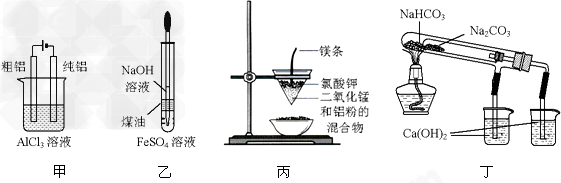
[? ]
①用甲图装置电解精炼铝 ②用乙图装置是为了较长时问地看到制备出来的白色的Fe(OH)2 ③用丙图装置可制得金属锰 ④用丁图装置验证NaHCO3和Na2CO3的热稳定性
A.①②?
B.②③?
C.③④?
D.①④
3、实验题 黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示
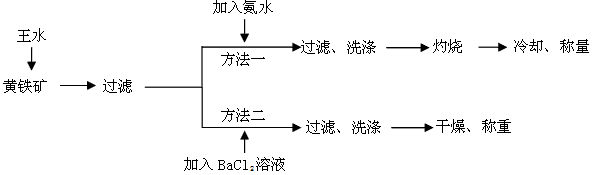
已知:
①王水是由1体积的浓硝酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
②黄铁矿和王水反应的方程式为FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
请回答下列问题:
(1)简述实验室配制王水的操作过程___________________________。
(2)方法一中过滤、洗涤、灼烧都用到的仪器是_______________。
(3)方法二中要判断BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是_______(填代号)
A.NaOH B.BaCl2 C.HCl D.Na2SO4
(4)实验室利用下列装置和试剂制取少量氯化氢气体
试剂:①浓硫酸 ②浓盐酸 ③食盐固体
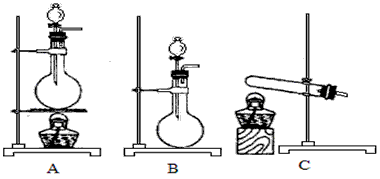
若选用试剂①②,则宜选择的装置是____________。若选用试剂①③,则应选择的装置是___________(填代号,下同);推测发生反应的化学方程式为____________________;
(5)方法一中,灼烧时发生反应的化学反应方程式为_____________________;已知称取黄铁矿样品的质量为1.50g,称得灼烧后固体的质量为0.4g,不考虑操作误差,则该矿石中FeS2的质量分数是______。
4、选择题 下列装置或操作正确且能达到实验目的的是
[ ? ]
A.分离乙酸和乙醇
B.形成锌铜原电池 ?
?
C.制备乙酸乙酯 ?
?
D.石油的分馏
5、实验题 我国规定饮用水的硬度不能超过25度。硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量。通常把1升水中含有10 mg CaO 称为1度。某化学实验小组对本地区地下水的硬度进行检测
实验中涉及的部分反应:
M2+(金属离子)+Y4-(EDTA)=MY2-
MEBT+Y4-(EDTA)=MY2++EBT(铬黑T)
实验过程如下:
(1)取地下水样品25.0mL进行预处理。已知水中由Ca2+、Mg2+和HCO3-所引起的硬度称为暂时硬度,可通过加热减小硬度,写出加热时所发生的化学反应(任写一个)____________________。预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是______________。
(2)将处理后的水样转移到250 mL的锥形瓶中,加入氨水一氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 0 mol/L的Y4-(EDTA)标准溶液进行滴定,滴定时眼睛应_______________,滴定终点时的实验现象是_______________
(3)滴定终点时共消耗Y4-(EDTA)溶液15.0mL,则该地下水的硬度是____。
(4)若实验时装有Y4-(EDTA)标准液的滴定管只用蒸馏水洗涤而未用标准液润洗。则测定结果将____(填“偏大”“偏小”或“无影响”)。