微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 &n bsp;某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

提示:BaSO4(s) Ba2+(aq)+S(aq)的平衡常数Ksp=c(Ba2+)·c(S),称为溶度积常数。
Ba2+(aq)+S(aq)的平衡常数Ksp=c(Ba2+)·c(S),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
参考答案:C
本题解析:A项加入Na2SO4会使Ba2+的浓度减小;B项,蒸发时,Ba2+与S的浓度变化是一致的;D项,温度不变,Ksp不变。
本题难度:一般
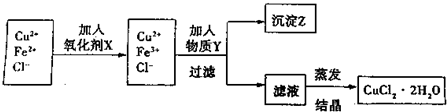
2、简答题 制取纯净的氯化铜晶体(CuCl2?2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2.
II.对I中所得到的溶液按下列步骤进行提纯.
已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH
Fe3+
1.9
3.2
Cu2+
4.7
6.7
|
试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是______.(填序号)
A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加入的物质Y是______.②写出沉淀Z在水中的沉淀溶解平衡方程式:______.
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2?2H2O),应采取的措施是______.
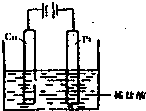
(4)①某同学利用反应:Cu+2H+═Cu2++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为______.(填“原电池”或“电解池”)②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液.
(5)已知一些难溶物的浓度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS
Ksp
6.3×10-18
2.5×-13
1.3×10-36
3.4×10-28
6.4×10-53
1.6×10-24
|
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的______除去它们.(选填序号)
①NaOH? ②FeS? ③Na2S.
参考答案:(1)根据框图,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为H2O2,故答案为:C;
(2)①结合题示,调节pH至4~5,使Fe3+全部沉淀,同样不引进新杂质,所以Y最好为CuO或Cu(OH)2或CuCO3,故答案为:CuO或Cu(OH)2或CuCO3;
②沉淀Z为Fe(OH)3,在溶液中存在溶解平衡:Fe(OH)3(s)?

?Fe2+(aq)+3OH-(aq),故答案为:Fe(OH)3(s)?

?Fe2+(aq)+3OH-(aq);
(3)CuCl2溶液在蒸发结晶过程中发生水解,为抑制其水解,根据Cu2++2H2O

Cu(OH)2+2H+,加入盐酸可起到抑制作用,并且在蒸发过程中要不断搅拌且不能蒸干.
故答案为:在HCl气流下加热浓缩,冷却结晶;
(4)①Cu与盐酸不反应,为使反应Cu+2H+═Cu2++H2↑发生,应设计成电解池,铜作阳极,故答案为:电解池;
②将反应Cu+2H+═Cu2++H2↑设计成电解池,可将铜作阳极,碳棒或铂为阴极,盐酸为电解质,设计电解池为
,
故答案为:

;
(5)①加入NaOH,易生成Hg(OH)2,Hg(OH)2不稳定,易分解最终生成有害物质Hg,并且加入NaOH成本较大,过量时引入新的杂质,②FeS较HgS、CuS易溶,加入FeS,可易生成HgS、CuS而除去溶液中的Cu2+、Pb2+、Hg2+,③加入Na2S,过量时易引入S2-杂质,所以只有②符合.
故答案为:②.
本题解析:
本题难度:一般
3、选择题 海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

注:溶液中某种离子的浓度小于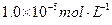 ,可认为该离子不存在;
,可认为该离子不存在;
实验过程中,假设溶液体积不变。

下列说法正确的是
A.沉淀物X为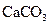
B.溶液M中存在 、不存在
、不存在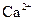
C.溶液N中存在 、
、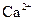
D.步骤②中若改为加入4.2g NaOH固体,沉淀物Y为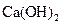 和
和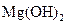 的混合物
的混合物
参考答案:A
本题解析:略
本题难度:一般
4、填空题 活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
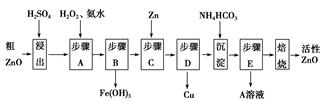
已知:几种离子生成氢氧化物沉淀时的pH如表:
待沉淀离子
| Fe2+
| Fe3+
| Zn2+
| Cu2+
|
开始沉淀时pH
| 6.34
| 1.48
| 6.2
| 5.2
|
完全沉淀时pH
| 9.7
| 3.2
| 8.0
| 6.4
|
请回答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
(2)A溶液中主要含有的溶质是 。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应ΔH>0,该反应能自发进行的原因是ΔS (选填“=”、“>”或“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
参考答案:(1)2Fe2++H2O2+2H+=2Fe3++2H2O 3.2~5.2 (2)(NH4)2SO4 (3)> (4)0.78
本题解析:(1)步骤A加入H2O2的目的是将Fe2+氧化为Fe3+便于除去,同时不引入新的杂质。由流程图看出该步操作只生成Fe(OH)3沉淀,结合表中数据可知需控制溶液pH为3.2~5.2之间。
(2)硫酸锌溶液中加入碳酸氢铵后生成碱式碳酸锌沉淀和硫酸铵。
(3)反应自发,且ΔH>0,则ΔS必大于0。
(4)由c(Zn2+)×c2(OH-)=Ksp
c(Zn2+)=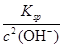 =
=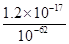 =1.2×10-5(mol·L-1),即1.2×10-5 mol·L-1×65 g·mol-1=7.8×10-4g·L-1,即0.78 mg·L-1
=1.2×10-5(mol·L-1),即1.2×10-5 mol·L-1×65 g·mol-1=7.8×10-4g·L-1,即0.78 mg·L-1
本题难度:困难
5、选择题 化学反应终点的判断是化学实验的重要环节,下列对化学反应终点判断不正确的是( )
A.向BaCl2溶液中加入适量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀
B.淀粉在稀硫酸的作用下水解后,加入NaOH使溶液呈碱性,加入新制Cu(OH)2后加热,若有砖红色沉淀生成,说明淀粉已经完全水解
C.将Na2SO4?10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水
D.用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明已达滴定终点
参考答案:A.向BaCl2溶液中加入适量Na2CO3溶液后,发生反应:BaCl2 +Na2CO3 =BaCO3↓+2NaCl,
少量上层清液于小试管中,滴加Na2CO3,若不再有沉淀产生,则沉淀完全;若还有沉淀生成,则不完全,故A正确;
B.淀粉在稀硫酸的作用下水解后,只要淀粉水解,就有葡萄糖生成,淀粉在稀硫酸的作用下水解后,加入NaOH使溶液呈碱性,加入新制Cu(OH)2后加热,若有砖红色沉淀生成,只能说明有淀粉水解,但不能说明淀粉不能完全水解,故B错误;
C.将Na2SO4?10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明固体已经恒重,说明硫酸钠已全部失去结晶水,故C正确;
D.滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,滴有酚酞的NaOH溶液呈粉红色,当滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明碱已全部反应完,故D正确;
故选B.
本题解析:
本题难度:简单