微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.12 g镁粉充分反应后,下图中比较符合反应事实的曲线是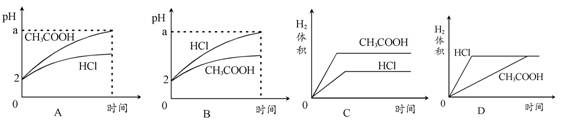
参考答案:B
本题解析:略
本题难度:简单
2、选择题 0.1 mol·L-1某酸HA溶液的pH=2,则该溶液中有关浓度关系式正确的是
A.c(H+)>c(A-)? B.c(H+)>c(HA)? C.c(OH-)>c(HA)? D.c(HA)>c(A-)
参考答案:AD
本题解析:c(酸)= 0.1 mol/L,pH=2,c(H+)=0.01mol/L< c(酸).所以该酸是弱酸。A. 在溶液中除了存在酸的电离平衡HA H+ +A-,外还存在水的电离平衡:H2O
H+ +A-,外还存在水的电离平衡:H2O H+ + OH-,所以c(H+)>c(A-)。正确。B.酸HA的电离作用是很微弱的。尽管H+由酸电离与水电离两部分产生,但其物质的量是很小的。因此c(HA)> c(H+)。错误。C.酸的浓度远大于水电离产生的H+ 或OH-的浓度。所以c(HA)> c(OH-)。错误。D.酸是弱电解质,其电离程度很小,酸分子的浓度远大于其电离产生的离子的浓度,所以c(HA)>c(A-)。正确。
H+ + OH-,所以c(H+)>c(A-)。正确。B.酸HA的电离作用是很微弱的。尽管H+由酸电离与水电离两部分产生,但其物质的量是很小的。因此c(HA)> c(H+)。错误。C.酸的浓度远大于水电离产生的H+ 或OH-的浓度。所以c(HA)> c(OH-)。错误。D.酸是弱电解质,其电离程度很小,酸分子的浓度远大于其电离产生的离子的浓度,所以c(HA)>c(A-)。正确。
本题难度:一般
3、选择题 常温下,将0.1 mo1·L一1的醋酸溶液加水稀释至原来体积的10倍,下列有关叙述正确的是
A.CH3 COOH的电离平衡常数增大为原来的10倍
B.CH3 COO一与CH3 COOH的浓度之比增大为原来的10倍
C.CH3 COO一与H十的浓度之积减小为原来的0.1
D.CH3 COOH与CH3 COO—的浓度之和减小为原来的0.1
参考答案:D
本题解析:A、醋酸的电离平衡常数只与温度有关,温度不变,醋酸的电离平衡常数不变,故A错误;B、加水稀释醋酸,促进醋酸电离,醋酸跟离子的物质的量增大,醋酸分子的物质的量减小,但醋酸是弱电解质不能完全电离,使CH3 COO一与CH3 COOH的浓度之比小于原来的10倍,故B错误;C、醋酸是弱电解质不能完全电离,稀释后浓度之积小于原来的0.1;D、溶液中CH3COOH与CH3COO—的物质的量的和没有变化,溶液体积增加后浓度之和减小为原来的0.1,故D正确。
本题难度:一般
4、选择题 下列事实能说明醋酸是弱酸的是?
①下当温度低于16.6℃时醋酸可凝结成冰一样晶体?②0.1 mol/L的醋酸钠溶液的pH约为9?③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多?④0.1mol/L的醋酸的pH值约为4.8?⑤pH等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多
A.②④⑤
B.②④
C.②③④
D.②③
参考答案:A
本题解析:醋酸钠溶液是盐溶液应该PH为7,实际上是9说明醋酸根发生了水解,醋酸是弱酸,②正确;0.1mol/L的醋酸的pH值应该为1,实际上是4.8,说明醋酸分子没有全部电离,醋酸是弱酸,④正确;如果醋酸是强酸则pH等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,消耗碱液的体积应该相同,实际上醋酸消耗的多说明醋酸是弱酸,溶液中存在没有电离的醋酸分子,所以耗碱增多,⑤正确;所以正确的是②④⑤答案选A。
本题难度:简单
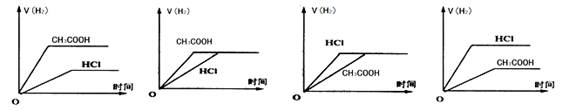
5、选择题 在体积相同,物质的量浓度相等的HCl溶液和CH3COOH溶液中分别加入足量Mg粉,产生H2的体积(同温同压下测定)的变化图示正确的是
A. B. C. D.
参考答案:C
本题解析:醋酸和盐酸都是一元酸,在溶液体积和物质的量浓度都相同的条件下,与足量镁粉反应生成的氢气体积相等;但由于醋酸是弱酸,溶液中存在电离平衡CH3COOH CH3COO-+H+,盐酸是强酸,因此盐酸与镁粉反应的速率快,反应所需的时间少,所以符合条件的图像是选项C,答案选C。
CH3COO-+H+,盐酸是强酸,因此盐酸与镁粉反应的速率快,反应所需的时间少,所以符合条件的图像是选项C,答案选C。
考点:考查弱电解质的电离、外界条件对反应速率的影响以及图像识别
本题难度:一般