微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经。
【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
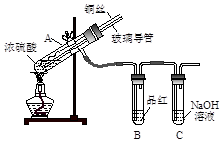

(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是?。
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有?。
(3)确定乙是否煅烧完全的操作是?。
(4)煅烧过程中一定发生的化学反应方程式为?。
【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。
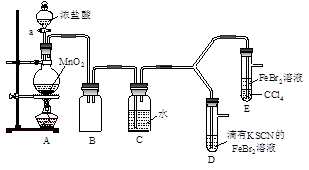
(5)根据下列实验操作和现象,填写实验结论。
实验操作
| 实验现象
| 结论
|
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。
| D装置中:溶液变红
E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。
| Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:
?
|
?
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。
ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应。
ⅲ.AgClO、AgBrO均可溶于水。
|
?
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因____?;
请设计简单实验证明上述解释?。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因?。
参考答案:(本题共12分)(1)在熄灭酒精灯后,B中的液体不会倒吸(1分)
(2)泥三角、坩埚(坩埚钳)(2分,坩埚钳不写不扣分)
(3)重复操作(再煅烧、冷却、称量),直至恒重(前后两次称量差不超过0.001g)。(2分)
(4)2CuS+3O2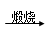 2CuO+2SO2 (2分)?(5)Cl2 >Br2 >Fe3+(1分)
2CuO+2SO2 (2分)?(5)Cl2 >Br2 >Fe3+(1分)
(6)①过量氯气和SCN –反应:2SCN-+Cl2→2Cl-+(SCN)2,使SCN-浓度减小,则Fe3+ +3SCN- Fe(SCN)3 平衡逆向移动而褪色(2分);取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理。(或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理。(其它合理答案也得分)(1分)
Fe(SCN)3 平衡逆向移动而褪色(2分);取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理。(或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理。(其它合理答案也得分)(1分)
②BrCl + H2O →HBrO + HCl反应只产生Cl-,不产生Br-(1分)
本题解析:(1)SO2极易溶于水,所以容易引起倒吸。由于B装置和A装置之间连接有橡皮管,所以该装置的另外一个特点是在熄灭酒精灯后,B中的液体不会倒吸。
(2)固体灼烧应该在坩埚中进行,所以还需要的仪器有泥三角、坩埚(坩埚钳)。
(3)要检验固体灼烧是否完全的正确操作应该是重复操作(再煅烧、冷却、称量),直至恒重(前后两次称量差不超过0.001g)。
(4)由于固体乙灼烧后固体质量减少,所以固体乙中一定含有CuS,因为Cu2S灼烧后固体质量不变,所以灼烧时反应的化学方程式是2CuS+3O2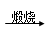 2CuO+2SO2。
2CuO+2SO2。
(5)A装置中产生氯气,D装置中溶液变红,这说明反应中有Fe3+生成,即氯气将亚铁离子转化为铁离子。E装置中水层溶液变黄,振荡后,CCl4层无明显变化,这说明反应中氯气首先氧化亚铁离子,所以根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性可知,氧化性强弱顺序是Cl2 >Br2 >Fe3+。
(6)①因为氧化性是Cl2>(SCN)2,所以过量氯气和SCN-反应:2SCN-+Cl2→2Cl-+(SCN)2,使SCN-浓度减小,则可逆反应Fe3++3SCN- Fe(SCN)3 平衡逆向移动而褪色。要证明上述结论,可以根据平衡移动原理,即取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理。(或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理。
Fe(SCN)3 平衡逆向移动而褪色。要证明上述结论,可以根据平衡移动原理,即取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理。(或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理。
②由于过量的Cl2和Br2反应生成的BrCl,BrCl与水发生水解反应生成盐酸和次溴酸,反应的方程式是BrCl + H2O →HBrO + HCl。反应只产生Cl-,不产生Br-,所以只能得到白色沉淀氯化银,得不到溴化银浅黄色沉淀。
本题难度:困难
2、选择题 已知:Ni+CuSO4=NiSO4+Cu、Cu+2AgNO3=Cu(NO3)2+2Ag,则下列判断正确的是( )
A.还原性:Ni>Cu>Ag
B.氧化性:Ni2+>Cu2+>Ag+
C.还原性:Ni<Cu<Ag
D.氧化性:Ni2+<Ag+<Cu2+
参考答案:反应Ni+CuSO4=NiSO4+Cu中,氧化剂是Cu2+,还原剂是Ni,氧化产物是Ni2+,还原产物是Cu,所以氧化性Ni2+<Cu2+,还原性Ni>Cu,反应Cu+2AgNO3=Cu(NO3)2+2Ag中,氧化剂是Ag+,还原剂是Cu,还原产物是Ag,氧化产物是Cu2+,所以氧化性Cu2+<Ag+,还原性Cu>Ag,所以还原性Ni>Cu>Ag,氧化性Ni2+<Cu2+<Ag+.
故选A.
本题解析:
本题难度:一般
3、选择题 近年来,都市里的医疗美容机构数量日渐增多。由于各机构水平参差不齐和执业医生鱼龙混杂,医疗美容纠纷日益增多,不法分子把有毒的H3AsO3用作脱毛剂坑害顾客。在浓盐酸中,H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As↓+ 3SnCl62- +6M。关于该反应的说法中正确的组合是
?
[? ]
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成7.5 g As,还原剂失去的电子为0.3 mol ④M为OH-
⑤SnCl62-是氧化产物
A.①②④⑤
B.①③⑤
C.①②③④
D.只有①③
参考答案:B
本题解析:
本题难度:一般
4、选择题 进行化学实验、观察实验现象,通过分析、推理得出正确的结论是化学学习的方法之一.下列对有关实验事实的解释正确的是( )
A.将N2和过量的O2在高温或放电的条件下反应得到红棕色的气体,说明NO为红棕色气体
B.用干净的铂丝蘸取少量溶液在酒精灯外焰上灼烧,发现火焰呈黄色,则溶液中含Na+
C.在AgNO3的溶液中加入锌粉,能置换出银,说明Ag+的还原性比Zn2+强
D.浓硫酸放入蔗糖中,能使蔗糖碳化,说明浓硫酸具有吸水性
参考答案:A、因N2和过量的O2在高温或放电的条件下发生反应:N2+O2?放电?.?2NO,NO无色,产生的NO迅速与O2反应2NO+O2=NO2,红棕色气体为NO2,故A错误;
B、因钠的焰色反应呈黄色,所以火焰呈黄色,说明溶液中含Na+,故B正确;
C、因AgNO3的溶液与锌粉反应:Zn+2AgNO3═Zn(NO3)2+2Ag,根据氧化剂的氧化性大于氧化产物的氧化性,Ag+的氧化性比Zn2+强,故C错误;
D、因浓硫酸将蔗糖碳化是将蔗糖中的H和O以2:1的形式脱去,体现了浓硫酸的脱水性,故D错误;
故选B.
本题解析:
本题难度:简单
5、填空题 某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4mL?0.5mol/L的亚硫酸钠溶液,蓝色恰好完全褪去.
(1)写出实验①中发生反应的离子方程式?.
(2)实验②中化学反应转移电子的物质的量是?.
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是?.
参考答案:
本题解析:
本题难度:一般