微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在298K、1.01×105Pa下,12g石墨在24g氧气中燃烧至反应物完全消耗,测得放出x?kJ(x>0)的热量.已知在该条件下,1mol石墨完全燃烧放出y?kJ(y>0)的热量.则石墨与氧气反应生成CO的热化学方程式表达正确的是( )
A.C(石墨,s)+O2(g)=CO(g)△H(298K)=-ykJ?mol-1
B.C(石墨,s)+O2(g)=CO(g)△H(298K)=-xkJ?mol-1
C.C(石墨,s)+ O2(g)=CO(g)△H(298K)=-(2x-y)kJ?mol-1
O2(g)=CO(g)△H(298K)=-(2x-y)kJ?mol-1
D.2C(石墨,s)+O2(g)=2CO(g)△H(298K)=-(2x-y)kJ?mol-1
参考答案:C
本题解析:
本题难度:简单
2、简答题 写出下列热化学方程式
(1)已知25℃、101kpa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.写出25℃、101kPa时的辛烷燃烧热的热化学方程式______.
(2)在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式______.
参考答案:(1)25℃、101kpa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,114g辛烷完全燃烧生成二氧化碳和液态水放出热量5517.6KJ/mol ,反应的热化学方程式为:C8H18(l)+252O2(g)=8CO2(g)+9H2O(g)△H=-5517.6KJ/mol,
故答案为:C8H18(l)+252O2(g)=8CO2(g)+9H2O(g)△H=-5517.6KJ/mol;
(2)N2和H2完全反应生成1molNH3放热46.0kJ热量,生成2mol氨气放热92KJ,氨气分解为吸热反应,反应的焓变为+92KJ,反应的热化学方程式为:2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol;
故答案为:2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol.
本题解析:
本题难度:一般
3、选择题 下列热化学方程式正确的是(注:△H的绝对值均正确)( ? )
A.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0?kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol(中和热)
C.S(s)+O2(g)═SO2(g)△H=-269.8kJ/mol(反应热)
D.2NO2═O2+2NO△H=+116.2kJ/mol(反应热)
参考答案:BC
本题解析:
本题难度:一般
4、填空题 (4分)已知25℃、101kpa时,CH3OH(l)的燃烧热为726.5 KJ/mol。
⑴写出该条件下CH3OH(l)完全燃烧的热化学方程式: 。
⑵已知有关反应的能量变化如下图,则反应CH4+H2O(g) CO+3H2的焓变△H=_______。
CO+3H2的焓变△H=_______。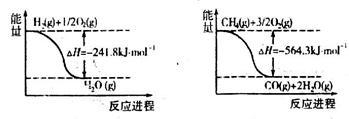
参考答案:(1)CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O(l);△H=" -726.5KJ/mol" (2分)
(2) 161.1 KJ·mol-1(2分)
本题解析:(1)热化学方程,要注意指明反应时的温度和压强,其次,方程中所有的反应物和产物都用括号注明它们在反应时的状态。燃烧,属于放热反应,故△H<0,此热化学方程式为
CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O(l);△H= -726.5KJ/mol。
(2)盖斯定律:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
由图可知H2+(1/2)O2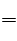 H2O △H="-24.18KJ/mol" ① CH4+(3/2)O2
H2O △H="-24.18KJ/mol" ① CH4+(3/2)O2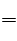 CO+2H2O △H=-564.3KJ/mol②
CO+2H2O △H=-564.3KJ/mol②
既有H2O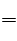 H2+(1/2)O2 △H="24.18KJ/mol" ③
H2+(1/2)O2 △H="24.18KJ/mol" ③
③×3+②
得CH4+H2O(g) CO+3H2 △H=" 161.1" KJ·mol-1
CO+3H2 △H=" 161.1" KJ·mol-1
考点:热化学方程。
点评:此题考核了热力学方程和盖斯定律,要求学生在书写的时候,要注意热力学方程的书写格式。
本题难度:一般
5、填空题 (15分)汽车尾气净化反应:2NO(g)+2CO(g)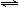 N2(g)+2CO2(g),请回答下列问题:
N2(g)+2CO2(g),请回答下列问题:
(1)对于气相反应,用某组分B平衡时的分压p(B)代替物质的量浓度c(B)也可表示平衡常数,记作KP,则该反应的平衡常数KP表达式为 ;
(2)已知:N2(g) + O2(g) ="2NO(g)" △H=+180.5kJ·mol-1
C(s) + O2(g) = CO2(g) △H=-393.5 kJ·mol-1
2C(s) + O2(g) ="2CO(g)" △H=-221kJ·mol-1
则2NO(g)+2CO(g)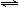 N2(g)+2CO2(g)的△H= ,该反应能自发进行的条件 (填“高温”、“低温”或“任意温度”);
N2(g)+2CO2(g)的△H= ,该反应能自发进行的条件 (填“高温”、“低温”或“任意温度”);
(3)在一定温度下,向体积为 V L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)="a" mol,n(NO)="2a" mol,n(N2)="b" mol。
①若保持体积不变,再向容器中充入n(CO2)=" b" mol,n(NO)=" a" mol,则此时v正 v逆(填“>”、“=”或“<”);
②在t2时刻,将容器迅速压缩到原容积的1/2,在其它条件不变的情况下,t3时刻达到新的平衡状态。请在下图中补充画出t2-t3-t4时段N2物质的量的变化曲线。

(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。

①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右;
②目前对氮氧化物(NOx)进行治理的方法比较多,其中吸附/吸收法广受欢迎。下列物质适合作为NOx吸收剂的是
A.活性炭 B.氨水 C.酸性尿素溶液 D.硫酸
参考答案:(1) (2分)
(2分)
(2)△H=-746.5KJ·mol-1(2分) 低温(2分)
(3)①=(2分) ②如图(2分)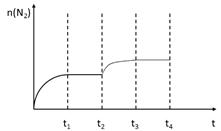
(4)①NO分解反应是放热反应,升高温度不利于反应进行(2分) 870K(1分)
② ABC (2分)
本题解析:(1)依据平衡常数定义可得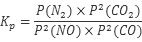 ;(2)根据盖斯定律可知,②×2-①-③即得到2NO(g)+2CO(g)
;(2)根据盖斯定律可知,②×2-①-③即得到2NO(g)+2CO(g) N2(g) +2CO2(g),所以该反应的△H=-393.5 kJ/mol×2-180.5kJ/mol+221kJ/mol=-746.5 kJ/mol;该反应△H<0,而△S<0,根据反应要想自发发生需△G=△H-T△S<0,故该反应自发发生的条件为低温;(3)在一定温度下,向体积为 V L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)="a" mol,n(NO)="2a" mol,n(N2)="b" mol,则该反应
N2(g) +2CO2(g),所以该反应的△H=-393.5 kJ/mol×2-180.5kJ/mol+221kJ/mol=-746.5 kJ/mol;该反应△H<0,而△S<0,根据反应要想自发发生需△G=△H-T△S<0,故该反应自发发生的条件为低温;(3)在一定温度下,向体积为 V L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)="a" mol,n(NO)="2a" mol,n(N2)="b" mol,则该反应
①若保持体积不变,再向容器中充入n(CO2)=" b" mol,n(NO)=" a" mol,则此时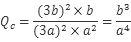 ,故Qc=K,故此时v正=v逆;②在t2时刻,将容器迅速压缩到原容积的1/2,在其它条件不变的情况下,瞬间n(N2)不变,但单位体积内体系分子总数增多,平衡正向移动,n(N2)增大,t3时刻达到新的平衡状态,故图像为:
,故Qc=K,故此时v正=v逆;②在t2时刻,将容器迅速压缩到原容积的1/2,在其它条件不变的情况下,瞬间n(N2)不变,但单位体积内体系分子总数增多,平衡正向移动,n(N2)增大,t3时刻达到新的平衡状态,故图像为:
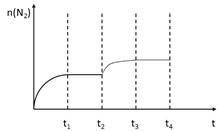 ;
;
(4)①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为NO分解反应是放热反应,升高温度不利于反应进行,故分解率降低;在n(NO)/n(CO)=1的条件下,在870K左右NO的转化率最高,故应控制的最佳温度在870K左右;②目前对氮氧化物(NOx)进行治理的方法比较多,其中吸附/吸收法广受欢迎,作为NOx的吸收剂既能与氮氧化合物反应或吸收,故A项活性炭能吸附气体,故A项正确;B项氨水和C项酸性尿素溶液均可与氮氧化合物反应,故B、C正确;D项硫酸不反应故D项错误;本题选ABC。
考点:化学反应原理综合题。
本题难度:困难