|
高中化学必备知识点《热化学方程式》试题强化练习(2017年最新版)(六)
2017-03-02 23:36:25
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 A2+B2===2AB的反应历程可以看作如下(△H表示该过程的能量变化):
Ⅰ.A2==="A" +A △H 1 Ⅱ.B2==="B" +B △H 2 Ⅲ.A+B===AB △H 3
则下列说法中正确的是( )
A.当△H3+(△H1+△H2) >0时,该反应是吸热反应;
B.当 2△H3+(△H1+△H2) > 0时,该反应是放热反应;
C.当 2△H3+(△H1+△H2 ) <0时,该反应是放热反应;
D.当1/2△H3+(△H1+△H2)<0时,该反应是吸热反应;
|
参考答案:C
本题解析:根据盖斯定律可知,I+Ⅱ+Ⅲ×2即得到反应A2+B2===2AB,所以该反应的反应热是△H= 2△H3+(△H1+△H2 )。因此选项C正确,答案选C。
考点:考查反应热的计算和判断
点评:在根据多个热化学方程式计算有关的反应热时,盖斯定律是最重要的定律,需要熟练掌握并能灵活运用。
本题难度:一般
2、计算题 I.甲醇是一种优质燃料,可制作燃料电池。工业上可用下列两种反应制备甲醇:
已知:CO(g) + 2H2(g)  CH3OH(g) ΔH1 CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2 CH3OH(g) + H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g) CO(g)+3H2(g)。 CO(g)+3H2(g)。
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图:
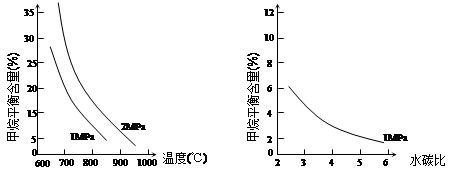
图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是 。
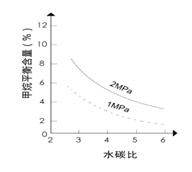
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为____ ____。
参考答案:(16分)
I.2ΔH1-2ΔH2+ΔH3(3分)
II.(1)其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动。(或描述降温的变化,3分)
(2)如下图(2分)(形状1分,标注1分)
(3)计算过程为:(格式2分,速率1分,常数2分,共5分)
CH4(g)+H2O(g)  CO(g)+3H2(g) CO(g)+3H2(g)
起始浓度(mol/L) 1 1 0 0
变化浓度(mol/L)0.8 0.8 0.8 2.4
平衡浓度(mol/L)0.2 0.2 0.8 2.4

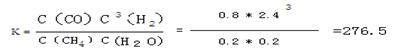 
(平衡常数没写单位不扣分)
III.O2 + 2H2O + 4e-=4OH-(3分)
本题解析:I.先将4个热化学方程式依次编号为①②③④,再观察、比较后可得:①×2—②×2+③=④,由盖斯定律可知,④的焓变=①的焓变×2—②的焓变×2+③的焓变=2ΔH1-2ΔH2+ΔH3;II.(1)先读图1,发现在1Mpa或2Mpa、600℃~1000℃时,随着温度的升高,甲烷平衡含量均逐渐减小,说明平衡向正反应方向移动;再根据温度对化学反应速率和化学平衡的影响规律,当其他条件不变时,升高温度,反应速率加快,平衡向吸热反应方向或正反应方向移动,则甲烷蒸气转化为氢气的正反应是吸热反应;(2)画图要点:①甲烷蒸气转化为氢气的正反应是气体体积增大的反应,当温度和水碳比保持不变时,增大压强,平衡向气体体积减小方向或逆反应方向移动,则甲烷平衡含量增大,因此2MPa时甲烷平衡含量与水碳比之间关系曲线一定高于1MPa时甲烷平衡含量与水碳比之间关系曲线;②当温度和压强保持不变时,随着水碳比的增大,甲烷平衡含量逐渐减小;(3)依题意可知该可逆反应中各组分起始、变化、平衡浓度,则:
CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g)
起始浓度(mol/L) 1 1 0 0
变化浓度(mol/L) 0.8 0.8 0.8 2.4
平衡浓度(mol/L) 0.2 0.2 0.8 2.4
根据平均反应速率的定义式,v(H2)=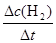 = =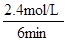 =0.4mol/(L?min) =0.4mol/(L?min)
根据化学平衡常数的定义式,K= = = mol2/L2≈276.5 mol2/L2 mol2/L2≈276.5 mol2/L2
III.甲醇燃料电池中正极的主要反应物为氧气,氧元素由0降为—2价,则1个氧气分子得到4个电子,在KOH溶液中只能用氢氧根离子使反应物和产物的电荷守恒,则O2+4e-→4OH-;左边比右边少4个H、2个O原子,根据氢、氧原子个数守恒可知反应物中还有2H2O,则正极反应式为O2 +4e-+2H2O =4OH-。
考点:考查化学反应原理,涉及根据盖斯定律求焓变、根据化学平衡图像得出温度对反应速率和平衡移动的影响规律、根据压强对化学平衡的影响规律画出图像、根据各组分(起始、变化、平衡)浓度模型法计算平均反应速率和平衡常数、碱性甲醇-空气燃料电池的正极反应式等。
本题难度:困难
3、选择题 25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量。下列表示该反应的热化学方程式中正确的是
[? ]
A.CH4O(l)+3/2O2(g) = CO2(g)+2H2O(l) △H=-725.8kJ/mol
B.2CH4O(l)+3O2(g)= 2CO2(g)+4H2O(l) △H=+1451.6kJ/mol
C.2CH4O+O2 = 2CO2+4H2O(l) △H=-22.68kJ/mol
D.CH4O(l)+3/2O2(g) = CO2(g)+2H2O(g) △H=-725.8kJ/mol
参考答案:A
本题解析:
本题难度:一般
4、计算题 (1)已知含11.2g KOH的稀溶液与1L0.1mol·L-1的H2SO4稀溶液反应放出11.46 KJ的热量。请写出KOH的稀溶液与的H2SO4稀溶液发生中和反应,表示中和热的热化学方程式为___________________________
(2)在相同条件下,下列两个反应的反应热分别为△H1和△H2表示:
①2H2(g)+O2(g)==2H2O(g)△H1,
②2H2(g)+O2(g)==2H2O(l)△H2,
则△H1和△H2的关系为__________________
参考答案:(1)KOH(aq)+1/2H2SO4(aq)==1/2K2SO4(aq)+H2O(l), =-57.3kJ/mol =-57.3kJ/mol
(2)△H1 >△H2
本题解析:
本题难度:一般
5、填空题 (8分)甲醇是一种优质燃料,可制作燃料电池。

(1)工业上可用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1 ②CO2(g)+3H2(g) CH3OH(g) ΔH1 ②CO2(g)+3H2(g) CH3OH(g) + H2O(g) ΔH2 CH3OH(g) + H2O(g) ΔH2
已知:③2H2(g)+ O2(g) = 2H2O(g) ΔH3。则2CO(g)+O2(g)=2CO2(g) 的反应热
ΔH=______(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。 CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、 减小、不变)。负极的电极反应式为_______ ____。

(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ;阳极泥为:
参考答案:(1)2△H1-2△H2+△H3; (2)>;<;
(3)减小 CH3OH-6e-+8OH-=CO32-+6H2O(4)粗铜,精铜,Ag、Au
本题解析:(1)①×2-②×2+③,整理可得2CO(g)+O2(g)=2CO2(g) ΔH=2△H1-2△H2+△H3;(20由于升高温度,CH4的平衡转化率增大。根据平衡移动原理:升高温度,平衡向吸热反应方向移动,所以正反应方向是吸热反应,ΔH4>0;增大压强,平衡逆向移动,CH4的平衡转化率降低。根据图示可知P1<P2(3)某实验小组设计如图b所示的甲醇燃料电池装置,工作原理是2CH3OH+3O2+4KOH=2K2CO3+6H2O,可见工作一段时间后,溶液的pH减小。负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是粗铜,阴极材料是精铜;在阳极上Cu及活动性比Cu强的金属Fe等失去电子,变为金属阳离子进入溶液,而活动性比Cu弱的金属Ag、Au等就沉淀在阳极底层,俗称阳极泥,所以阳极泥为Ag、Au。
考点:考查盖斯定律的应用、温度、压强对物质转化率的影响、燃料电池的各种原理及电镀的知识。
本题难度:困难
|