微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:
①该反应的气体产物是CO2;
②该反应的气体产物是CO;
③该反应的气体产物是?。
(2)计方案?如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
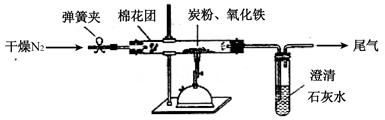
(3)查阅资料:
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:?。
(4)实验步骤:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为?。
(5)数据处理:
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
?。
(6)实验优化:
学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是?。
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:
?。
参考答案:⑴CO2、CO的混合物
⑶NH4++NO2—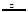 N2↑+2H2O
N2↑+2H2O
⑷步骤②中是为了排除空气中的CO2,步骤④是为了赶出所有的CO2,确保完全吸收
⑸2C+Fe2O3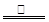 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
⑹①Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M (BaCO3)>M(CaCO3),称量时相对误差小。②在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
本题解析:(1)根据极端假设可知还有一种情况就是两者的混合物,即CO2、CO的混合物。
(3)用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液制氮气反应的离子方程式为:NH4++NO2—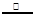 N2↑+2H2O。
N2↑+2H2O。
(4)步骤②通入氮气的目的是排除装置中的CO2。步骤④通入氮气的目的是将生成的CO2全部通入澄清石灰水中。
(5)由题意可知碳粉过量,产生的CO2为0.02mol,剩余的固体为3.76g,所以固体中有单质铁2.24g,则剩余的碳粉为3.76-2.24=1.52g,所以参加反应的碳粉为2-1.52=0.48g=0.04mol,则可以确定生成CO为0.02mol,因此方程式为:2C+Fe2O3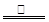 2Fe+CO↑+CO2↑。
2Fe+CO↑+CO2↑。
(6)①应将澄清石灰水换成Ba(OH)2溶液的原因是Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全,M (BaCO3)>M(CaCO3),称量时相对误差小。②从环保的角度来看生成的CO也要处理掉,因此应该在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
点评:本题综合性较强,难度较大,主要考查学生分析问题和解决问题的能力。
本题难度:一般
2、实验题 (20分)某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
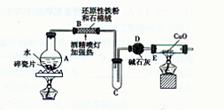
【探究一】设计右图所示装置进行“铁与水反应”的实验。
 ?
?
(1)硬质试管中发生反应的化学方程式为?。
(2)反应前A中投放碎瓷片的目的是?。
(3)装置E中的现象是?。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于?后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同)?。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe?②Fe3O4和Fe?③只有Fe3O4?④只有Fe
(6)另一份用___?(填仪器名称)加入?,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液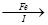 FeSO4溶液
FeSO4溶液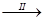 FeSO4·7H2O晶体
FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是?(用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括?、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有?。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
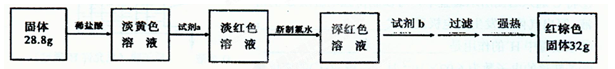
(9)试剂b的化学式是?____。
(10)计算反应后B装置中铁元素的质量分数为?;根据计算结果判断反应后硬质试管B中固体物质的成分是?。
?
参考答案:

本题解析:略
本题难度:简单
3、选择题 下列各组物质中,酸性由强到弱排列顺序错误的是( )
A.HClO4?H2SO4?H3?PO4
B.HClO4?HClO3?HClO2
C.H2?SO4?H2?SO3?H2?CO3
D.HC1O?HBrO4?HIO4
参考答案:D
本题解析:
本题难度:简单
4、选择题 配制一定物质的量浓度溶液时,会导致所配溶液浓度偏大的操作是
A.在用蒸馏水洗涤烧杯时,洗液未全部注入容量瓶中
B.定容摇匀后,发现液面低于刻度线,又加水到刻度
C.定容时俯视刻度线
D.用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理
参考答案:C
本题解析:应逐个分析每个选项,找出正确的选项:因为cB=nB/V,若错误操作使nB增大,V减小,则cB偏大,若错误操作使nB减小,V增大,则cB偏小.A操作使nB减少,B操作使V增大,C操作使V减小,D操作对nB和V均无影响,故A、B操作使cB减小,C操作使cB增大,D无影响.
本题难度:简单
5、实验题 (7分)实验室利用如图装置进行中和热的测定,请回答下列问题:
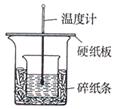
(1)在操作正确的前提下,提高中和热测定准确性的关键是?
(2)做1次完整的中和热测定实验,温度计需使用?次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么??
(3)请为本实验设计数据记录表格:
参考答案:(7分)(1)保温(1分)
(2)3次?(1分)不同意,因为不同的温度计误差不同。(2分)
(3)(3分)
温度
实验次数
起始温度t1/℃
[
终止温度
t2/℃
?
温度差
(t2—t1)/℃
HCl
NaOH
平均值
1
?
?
?
?
?
2
?
?
?
?
?
3
?
?
?
?
?
本题解析:略
本题难度:一般