| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《原电池原理》高频试题巩固(2017年最新版)(四)
(4)很多硫酸厂为回收利用SO2,直接用氨水吸收法处理尾气。 ① 用15.0 mL 2.0 mol/L氨水吸收标准状况下448 mL SO2,吸收液中的溶质为 。 ② 某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00 mL,则酸性KMnO4,溶液中c(KMnO4) = 。 (5)氨气用途广泛,可以直接用于燃料电池,下图是用氨水作原料的燃料电池的工作原理。 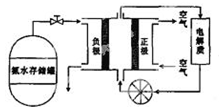 氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液,氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是 ,负极的电极反应式是 。 参考答案:(1)CaSO4+4C 本题解析:(1)由流程图可知反应III是硫酸钙与焦炭在高温条件下反应生成CaS和CO,化学方程式为CaSO4+4C 本题难度:一般 2、选择题 如图所示装置,电流计的指针发生偏转,正极变粗,负极变细,符合这种情况的是( ) |
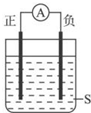
参考答案:A.Al与浓硝酸发生钝化,负极应为铜,故A错误;
B.Fe比Ag活泼,可为原电池的负极,在正极上析出铜,故B正确;
C.Al与浓硝酸发生钝化,负极铜,正极析出气体,故C错误;
D.Zn比Cu活泼,应为原电池的负极,故D错误.
故选B.
本题解析:
本题难度:一般
3、选择题 下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用银片做阳极,铁片作阴极,电解硝酸银溶液,铁片表面出现一层银
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
参考答案:A.铜为正极,正极上氢离子得电子被还原生成氢气,则铜片表面出现气泡,故A正确;
B.为电镀装置,银离子在阴极被还原生成银,故B正确;
C.铜和氯化铁发生氧化还原反应生成氯化铜和氯化亚铁,不能置换出铁,故C错误;
D.锌置换出铜,形成原电池反应,电化学反应较化学反应快,故D正确.
故选:C.
本题解析:
本题难度:一般
4、选择题 氢氧燃料电池是一种新能源。如图为氢氧燃料电池示意图。下列说法不正确的是(? )
A.a极是正极,b极是负极
B.该装置能将化学能转化为电能
C.电子由a极通过导线流向b极
D.供电时总反应为2H2+O2=2H2O
参考答案:A
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。所以在氢氧燃料电池中,氢气在负极通入,氧气在正极通入,则a是负极,b是正极,A不正确,其余选项都是正确的,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,注重考查学生灵活应变能力,有利于提高学生的逻辑推理能力。该题的关键是熟练掌握原电池的原理,特别是电极名称的判断、电极反应式的书写等。
本题难度:一般
5、填空题 (14分)(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)  4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,则:υ(NO2)为 、5min时,N2O5占混合气体体积分数是 。
4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,则:υ(NO2)为 、5min时,N2O5占混合气体体积分数是 。
阅读资料,回答(2)、(3)小题
锌铜原电池用画图的方式(如图)表示很不方便,常常采用电池图式表达式,如Zn|ZnSO4(1mol/L)||CuSO4(1mol/L)|Cu 上式中,发生氧化反应的负极写在左边,发生还原反应的正极写在右边。用实垂线“|”表示电极与溶液之间的界面,用双实垂线“||”表示盐桥。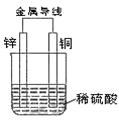
(2)上述资料列举的电池中,锌片上发生的电极反应式是 ,
(3)现有一电池,其图式表达式为Cu|CuSO4(1mol/L)||Fe2(SO4)3(0.5mol/L)|C。该电池中,正极的电极反应式是 ,负极的电极反应式是 。
(4)写出支链只有一个乙基且式量最小的烷烃的结构简式
参考答案:(共14分)
(1) υ(NO2)="0" .16mol/(L·min )(2分) 61.5% (3分)
)(2分) 61.5% (3分)
(2)Zn-2e-=Zn2+(2分)
(3)2Fe3++2e-=2Fe2+(2分) Cu-2e-=Cu2+(2分)
(4) (3分)
(3分)
本题解析:略
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学必考知识点《物质的分类.. | ||