微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)煤经过化学加工可转化为气体或液体燃料以及各种化工产品,从而提高了煤的利用率。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) CO(g)+H2(g)△H=131.5kJ·mol-1
CO(g)+H2(g)△H=131.5kJ·mol-1
①下列措施中,不能提高碳的转化率的是?(填字母序号)。
a.容器的容积不变,增加水蒸汽的物质的量
b.缩小容器的容积,增大压强
c.及时将水煤气从容器中移走
d.其他条件不变,升高温度
②又知,C(s)+CO2(g) 2CO(g)△H=172.5kJ·mol-1
2CO(g)△H=172.5kJ·mol-1
则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为?。
CO2(g)+H2(g)的焓变(△H)为?。
(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2 CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
 ?①a处通入的是?(填物质名称),左侧电极上发
?①a处通入的是?(填物质名称),左侧电极上发
生?(填“氧化”或“还原”)反应。
②该电池工作过程中,H+的移动方向为从?到
?(填“左”或“右”)
③该电池正极反应式为?。
④若用该电池提供的电能电解60mL NaCl溶液,设有
0.01molCH3OH完全放电,NaCl足量,且电解产生的
Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=?。
(3)将等量的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中进行如下反应,
CO(g)+H2O(g) CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:
CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:
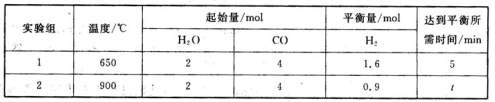
①在实验1中,以v(CO2)表示该反应的反应速率为?mol·L-1·min-1;
②在实验2中,t?5。(填“>”、“<”或“=”)
2、简答题 (19分)钒有金属“维生素”之称,研究发现钒的某些化合物对治疗糖尿病有很好的疗效。
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:
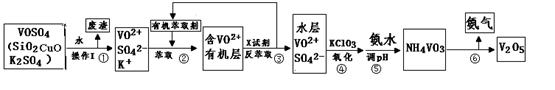
请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层)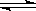 VOM2(有机层) + H2SO4?(水层)?
VOM2(有机层) + H2SO4?(水层)?
步骤②中萃取时必须加入适量碱,其原因是?。
步骤③中X试剂为?。
(2)步骤④的离子方程式为?
(3)该工艺流程中,可以循环利用的物质有??和?。
(4)操作Ⅰ得到的废渣,用?溶解,充分反应后,?,(填写系列操作名称)称量得到mg氧化铜。
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
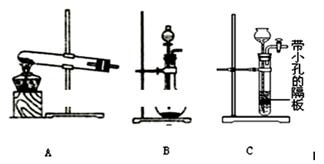
?
| 实验装置
| 实验药品
| 制备原理
|
甲小组
| A
| 氢氧化钙、氯化铵
| 反应的化学方程式为①?
|
乙小组
| ②?
| 浓氨水、氢氧化钠固体
| 分析产生氨气的原因③?
|
?
3、选择题 对于平衡体系mA(g)+nB(g)  pC(g)+qD(g)? ΔH<0。下列结论中错误的是
pC(g)+qD(g)? ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
4、选择题 在10℃时某化学反应速率为0.1mol/(L·min),若温度每升高10℃反应速率增加到原来的2倍。为了把该反应速率提高到1.6mol/(L·nim),则该反应需在什么温度下进行
[? ]
A.30℃
B.40℃
C.50℃
D.60℃
5、选择题 合成氨需要的H2由煤和水反应制得,其中一步反应为:CO(g)+H2O(g)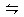 CO2(g)+H2(g)?△H>0,要使CO转化率提高,可采取(?)
CO2(g)+H2(g)?△H>0,要使CO转化率提高,可采取(?)
A.增大H2O(g)的浓度
B.增大CO的浓度
C.降低温度
D.增大压强