微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是( )
A.碳酸钙与稀HNO3:CO32-+2H+=CO2↑+H2O
B.Cu与AgNO3溶液:Cu+2Ag+=Cu2++2Ag
C.Fe与稀H2SO4:2Fe+6H+=2Fe3++3H2↑
D.Ba(OH)2与稀H2SO4:Ba2++SO42-=BaSO4↓
参考答案:q、碳酸钙与稀HNO3反应的离子方程式为:CqCO3+2H+=CO2↑+H2O+Cq2+;故q错误;
B、Cu与q七NO3溶液反应生成银和硝酸铜,反应的离子方程式为:Cu+2q七+=Cu2++2q七,故B正确;
C、Fe与稀H2SO4:反应生成硫酸亚铁和氢气,反应离子方程式为:Fe+2H+=Fe2++H2↑,故C错误;
D、Bq(OH)2与稀H2SO4反应生成硫酸钡沉淀和水,反应离子方程式为:2OH-+2H++Bq2++SO42-=BqSO4↓+H2O;故D错误
故选B.
本题解析:
本题难度:简单
2、选择题 下列反应的离子方程式书写正确的是( )
A.碳酸钠水CO32-+H2O=HCO3-+OH-
B.将SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓
C.澄清石灰水与盐酸反应:H++OH-=H2O
D.过量的CO2气体通入NaAlO2溶液中:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-
参考答案:A、碳酸钠水解离子方程式:CO32-+H2O?HCO3-+OH-,故A错误;
B、将SO2通入次氯酸钙溶液中,二氧化硫被次氯酸氧化:Ca2++ClO-+SO2+H2O=Cl-+2H++CaSO4↓,故B错误;
C、澄清石灰水与盐酸反应的离子方程式为:H++OH-=H2O,故正确;
D、过量的CO2气体通入NaAlO2溶液中生成碳酸氢根离子:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-,故D错误;
故选C.
本题解析:
本题难度:简单
3、选择题 下列离子方程式正确的是
[? ]
A.向纯碱溶液中加入少量醋酸:CO32-+H+=HCO3-
B.向明矾溶液中滴加过量氨水:Al3++4OH-=AlO2-+2H2O
C.向稀硫酸中加入少量氢氧化钡溶液:H++SO42-+Ba2++OH-=?BaSO4↓+?H2O
D.向烧碱溶液中通入少量二氧化碳:2OH-+CO2=?CO32-+?H2O
参考答案:D
本题解析:
本题难度:一般
4、选择题 离子方程式H++OH-═H2O可表示强酸和强碱生成可溶性盐这一类中和反应.下列物质间的反应能用该离子方程式表示的是( )
①稀H2SO4+Ba(OH)2溶液 ②澄清石灰水+稀HNO3 ③稀HNO3+Cu(OH)2 ④醋酸和KOH ⑤Ba(OH)2溶液+稀HNO3 ⑥次氯酸+NaOH ⑦盐酸+氨水.
A.只有②⑤
B.除③④⑥⑦
C.只有⑤
D.除④
参考答案:离子方程式H++OH-═H2O可表示强酸和强碱生成可溶性盐这一类中和反应.
①硫酸为强酸,Ba(OH)2为强碱,硫酸钡为难溶性盐,则二者反应不能用离子反应H++OH-=H2O表示,故①错误;
②氢氧化钙为强碱,硝酸为强酸,硝酸钙为可溶性盐,则二者反应的离子反应为H++OH-=H2O,故②正确;
③氢氧化铜为强碱,硝酸为强酸,硝酸铜为可溶性盐,则二者反应不能用离子反应H++OH-=H2O表示,故③错误;
④氢氧化钾为强碱,醋酸为弱酸,醋酸钾为可溶性盐,则二者反应不能用离子反应H++OH-=H2O表示,故④错误;
⑤氢氧化钡为强碱,硝酸为强酸,硝酸钡为可溶性盐,则二者反应的离子反应为H++OH-=H2O,故⑤正确;
⑥氢氧化钠为强碱,次氯酸为弱酸,次氯酸钠为可溶性盐,则二者反应不能用离子反应H++OH-=H2O表示,故⑥错误;
⑦氨水为弱碱,盐酸为强酸,氯化铵为可溶性盐,则二者反应不能用离子反应H++OH-=H2O表示,故⑦错误.
故选A.
本题解析:
本题难度:简单
5、填空题 现有一种溶液,其中可能含有Mg2+、Al3+、Fe2+、Cu2+、NH4+.当加入一种淡黄色固体并加热溶解时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.试回答下列问题:
(1)最终的白色沉淀的成分是(填化学式)______,你的理由是______.
(2)试确定该溶液中可能含有以上离子中的哪些离子并计算其相应的物质的量,完成下表
可能含有的离子
(填离子符号) | ______ | ______ | ______ | ______ | ______
相应的物质的量
______
______
______
______
______
|
(3)图中a点的值为______.
(4)图中b点的气体组成成分是(填化学式)______,其物质的量之比是______.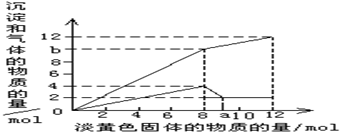
参考答案:(1)淡黄色粉末是过氧化钠,溶液时无色透明,排除铁离子和铜离子,首先加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,当加入过量的过氧化钠时,生成白色沉淀,推断一定有Mg2+,通过图象知,在加入过量的过氧化钠的过程中,沉淀部分溶解,推断一定含有Al3+,氢氧化镁不溶于强碱,氢氧化铝是两性氢氧化物,可以溶于强碱,最终的白色沉淀的成分是氢氧化镁,故答案为:Mg(OH)2;氢氧化镁不溶于强碱,氢氧化铝是两性氢氧化物,可以溶于强碱;
(2)淡黄色粉末是过氧化钠,溶液时无色透明,排除铁离子和铜离子,首先加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,由上式看出加入的量与生成量的比例,根据a-12mol这一段,所得氢氧化镁的物质的量是2mol,所以含有镁离子其物质的量为2mol,消耗氢氧化钠4mol,即在0-8mol这一段内,共生成沉淀4mol,所以另外2mol是氢氧化铝,即铝离子的物质的量为2mol,根据铵离子与氢氧化钠的氢氧根反应生成氨气,生成6mol的氨气,所以含有铵根离子是6mol,再之后是曲线了,这是因为铵离子几乎消耗完全,只剩下过氧化,与水反应生成氧气,而这反应会受温度,浓度等影响,因此会随着反应的反应,反应速率会变化,因此是曲线,故答案为:可能含有的离子
(填离子符号)Mg2+Al3+NH4+相应的物质的量2mol2mol6mol(3)看另一条图象,图象中有升有降,根据a-12mol这一段,所得氢氧化镁的物质的量是2mol,所以含有镁离子其物质的量为2mol,消耗氢氧化钠4mol,即在0-8mol这一段内,共生成沉淀4mol,所以另外2mol是氢氧化铝,即铝离子的物质的量为2mol,当氢氧化铝全部转化为四羟基合铝酸钠时,消耗消耗氢氧化钠2mol,即过氧化钠1mol,所以a=9.故答案为:9;
(4)先把图象分两截看,0-8一段,8-a一段,之后一段,分析0-8这段图象,加入8mol过氧化钠,生成4mol氧气,图象中明显生成b=10mol气体,所以生成氨气是6mol,氨气和氧气的物质的量之比是3:2,故答案为:NH3、O2;3:2.
本题解析:
本题难度:简单