微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是
A.与W相邻的同主族元素可制成重要的半导体材料
B.元素原子半径从大到小的顺序是X、Y、Z
C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构
D.W、Y、Z元素对应的氢化物稳定性最强的是H2Y
参考答案:D
本题解析:根据题意可得:W是C;X是Mg; Y是S;Z是Cl。A.与C元素相邻的同主族元素Si可制成重要的半导体材料。正确。B.元素Mg、S、Cl是同一周期的元素,原子序数越大,原子半径就越小。因此原子半径从大到小的顺序是Mg、S、Cl.正确。C.在CCl4分子中C、Cl原子通过共价键结合且最外层均达到8电子结构。正确。D.C、S、Cl三种元素中非金属性最强的是Cl元素。元素的非金属性越强,其对应的氢化物稳定性就越强,所以稳定性最强的是HCl.错误。
本题难度:一般
2、选择题 下列有关说法不正确的是
A.零族元素的单质在常温下都是气体
B.第ⅡA族元素都是金属元素
C.Fe位于周期表的第四周期,第ⅧB族
D.第ⅦA族元素的单质在常温下有气态、液态、固态
参考答案:C
本题解析:A 正确,零族元素的单质是稀有气体,在常温下都是气体
B 正确,第ⅡA族元素都是金属元素
C 错误,Fe位于周期表的第四周期,第Ⅷ族
D 正确,第ⅦA族元素的单质是氟其、氯气、溴、碘,在常温下有气态、液态、固态
本题难度:一般
3、简答题 (12分)(1)下列原子的外围电子排布式(或外围轨道表示式)中,那一种状态的能量较低?并指出处于能量较低状态时原子中的未成对电子数

(2)31号元素镓(Ga)是半导体材料之一。
①写出镓原子的电子排布式,指出镓元素在元素周期表中的位置。
②写出镓元素的最高价氧化物、氯化物的化学式。
参考答案:(1)①B? 3个? ②A? 1? ③A? 6个?(共6分)
(2)①1S2 2S2 2P6 3S2 3P6 3d10 4S2 4P1?(2分)
第四周期ⅢA族?(2分)
②Ga2O3? GaCl3?(2分)
本题解析:(1)①因为轨道中的电子处于全充满或半充满是稳定的,B稳定,其中未成对电子数3个,答案选B。
②3s的轨道的能量低于3p的,能量越低越稳定,A正确,其中未成对电子数是1个,答案选A。
③因为轨道中的电子处于全充满或半充满是稳定的,A正确,其中未成对电子数是6个,答案选A。
(2)①根据构造原理可知,镓原子的电子排布式为1S2 2S2 2P6 3S2 3P6 3d10 4S2 4P1,所以镓元素在元素周期表中的位置第四周期ⅢA族。
②第ⅢA元素的最高价是+3价,所以最高价氧化物、氯化物的化学式分别是Ga2O3、GaCl3。
本题难度:一般
4、填空题 在原子结构的探索过程中,很多科学家作出了相应的贡献,我国古代的?认为物质是无限可分的,近代原子学说是由??提出的,?发现了铀的放射性,卢瑟福通过?实验,提出了原子结构的行星模型。
参考答案:惠施,道尔顿, 贝克勒尔,a散射
贝克勒尔,a散射
本题解析:略
本题难度:简单
5、填空题 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
周期
| ⅠA
| ?
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| ?
|
2
| ?
| ?
| ?
| ②
| ③
| ④
| ?
| ?
|
3
| ⑤
| ?
| ⑥
| ?
| ?
| ⑦
| ⑧
| ?
|
?
(1)请画出元素⑥的离子结构示意图:?。
(2)元素⑦中质子数和中子数相等的同位素符号是:?。
(3)④、⑤、⑦的离子半径由大到小的顺序为:?。
(4)②的最高价氧化物对应水化物的电离方程式为:?。
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为:?。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为:?。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量,写出A与B反应的热化学方程式:?。
参考答案: (1)?
(1)?
(2)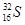 ?(或32S)? …… 1分
?(或32S)? …… 1分
(3)S2->O2-> Na+? …… 1分?
(4)H2CO3? HCO3- + H+? HCO3- ? CO32- + H+ …… 1分(只写一步也给分)
(5)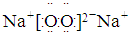 …… 1分?
…… 1分?
(6)CH4-8e-+10OH-= CO32-+7H2O? …… 2分
(7)N2H4(l)+2H2O2(l) = 4H2O(l)+N2(g)? ΔH="-1676" kJ/mol? …… 2分
本题解析:(1)⑥元素为第三周期第三主族元素铝,原子序数为13,其离子结构示意图为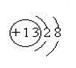
(2)元素⑦为S元素,质子数和中子数相等,则质量数是32,其同位素符号是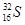 ?(或32S),
?(或32S),
(3)④、⑤、⑦的离子分别是O2-、Na+、S2-,根据半径的大小主要由电子层数、核电荷数决定,电子层数越多半径越大,核电荷数越多半径越小,所以3种离子的半径大小顺序为S2->O2-> Na+,
(4)②为碳元素,最高价氧化物对应水化物为碳酸,属于弱酸,其电离方程式为:H2CO3? HCO3- + H+? HCO3- ? CO32- + H+,
(5)④、⑤两种元素分别为氧、钠元素,原子按1:1组成的化合物为Na2O2,其电子式为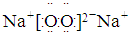
(6)由表中两种元素形成的5核10电子分子应是CH4,该电池在碱性条件下的负极反应式为:CH4-8e-+10OH-= CO32-+7H2O
(7)A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料,则A为N2H4, B是一种常见强氧化剂,则B为H2O2, 根据所给数据可得A与B反应的热化学方程式:N2H4(l)+2H2O2(l) = 4H2O(l)+N2(g)? ΔH="-1676" kJ/mol
本题难度:一般