微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是(?)
A.强电解质溶液的导电能力一定比弱电解质溶液强
B.因为醋酸是弱电解质,盐酸是强电解质,因此中和等体积等物质的量浓度的醋酸和盐酸时,中和盐酸消耗的氢氧化钠比中和醋酸多
C.物质的量浓度相同的磷酸钠和磷酸溶液中PO43―的物质的量浓度相同
D.足量锌分别和等体积、等物质的量浓度的盐酸和醋酸反应时产生H2的量相等,放出H2的速率不等
参考答案:D
本题解析:A 错误,强电解质溶液的导电能力不一定比弱电解质溶液强
B 错误,消耗的氢氧化钠一样多
C 错误,磷酸钠是强电解质,而磷酸是弱电解质,故PO43―的物质的量浓度不相同
D 正确
本题难度:一般
2、选择题 0.1mol/L某一元弱酸水溶液,在100℃和20℃时相比,其C(H+)前者比后者? (? )
A.大
B.小
C.相等
D.不能肯定
参考答案:D
本题解析:升高温度会促进弱酸的电离,但该酸可能在100℃有大量的挥发,故不能肯定。
本题难度:简单
3、选择题 已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入
0.1mol/L NaOH溶液,其 pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是
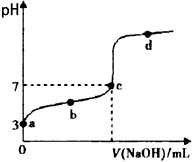
[? ]
A.a点表示的溶液中c(CH3COO-)=10-3 mol/L
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中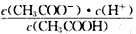 均等于K
均等于K
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
①pH=2和pH=1的H2SO4中c(H+)之比为1∶10
②0.2mol·L-1与0.1mol·L-1醋酸中,c(H+)之比大于2∶1
③纯水在80℃和20℃时,pH相等
④FeCl3溶液中c(Fe3+)与c(Cl-)之比为1∶3
⑤同温时,pH=10的Ba(OH)2溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
⑥100mL 0.1 mol·L-1的醋酸与10 mL 1.0 mol·L-1的醋酸中H+的数目,前者多
A.①④⑤
B.①⑤⑥
C.①②⑤
D.①②③⑥
参考答案:B
本题解析:略
本题难度:一般
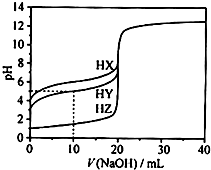
5、选择题 25℃时,用浓度为0.1000mol?L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol?L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)=
+c(Z-)+c(OH-)