微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极。
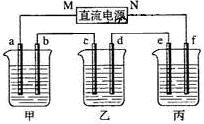
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。据此回答下列问题:
(1)电极b上发生的电极反应为?;
(2)计算电极e上生成的气体在标准状态下的体积:?;
(3)电解后甲溶液的pH?(填“增大”、“减小”或“不变”),简述其原因:?;
(4)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
?。
参考答案:
(1)4OH--4e-=2H2O + O2↑(2分)
(2)5.6 L (2分)
(3)增大(1分)因为相当于电解水(1分)
(4)能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水的反应(2分)
本题解析:(1)乙中c电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。
(2)当乙中有16gCu析出时,转移的电子为0.5mol。而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。丙中为K2SO4,相当于电解水,由方程式2H2O 2H2↑+O2↑可知,生成2molH2,转移4mol电子,所以当整个反应中转移0.5mol电子时,生成的H2为0.25mol,标况下的体积为0.25mol×22.4L/mol=5.6L。
2H2↑+O2↑可知,生成2molH2,转移4mol电子,所以当整个反应中转移0.5mol电子时,生成的H2为0.25mol,标况下的体积为0.25mol×22.4L/mol=5.6L。
(3)甲中相当于电解水,故NaOH的浓度增大,pH变大。
(4)铜全部析出后,电解质变为H2SO4,所以电解反应仍能进行。
本题难度:一般
2、选择题 下列各装置中都盛有0.1mol-L-1的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀速率由快到慢的顺序是( )
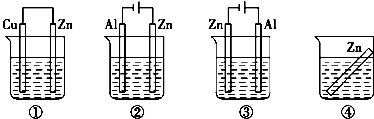
A.③①④②
B.①②④③
C.①②③④
D.②①④③
参考答案:①中锌作负极,发生电化学腐蚀,加快锌的腐蚀,②中锌作电解池阳极,在外加电源的作用下,更加快锌的腐蚀,③中锌作电解池阴极,不易被腐蚀,④中发生化学腐蚀,所以腐蚀速率由快到慢的顺序为②①④③.
故选D.
本题解析:
本题难度:简单
3、填空题 (1)如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端?(填高、低、不变。下同);当杠杆为导体时,A端比B端?。
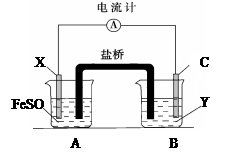
(2)依据氧化还原反应:Fe+Cu2+=Fe2++Cu设计的原电池如下图所示,其中Y为可溶性硫酸盐。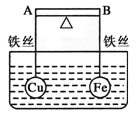 ?
?
请回答下列问题:
①电解质溶液Y是?;(填化学式)
②X电极发生的电极反应为?;
③装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 填(“原电池”或“电解池”),A中溶液浓度 (填增大、不变、变小),铜棒的电极名称为 (填“正极”、“负极”、“阴极”或“阳极”)
(4)把(2)中盐桥改为铜棒,其它不变,电流计的指针 (填“会”、“不会”)发生偏转,理由是 ?。
参考答案:(1)高;低 (2)①CuSO4②Fe-2e-=Fe2+ ③B
(3)会、电解池、不变、正极 (4)不、两池都没有可自发进行的氧化还原反应
本题解析:(1)当杠杆为绝缘体时,加入硫酸铜溶液后,铁和硫酸铜发生置换反应生成铜附着在铁表面,质量增加,因此是A端比B端高;当杠杆为导体时,加入硫酸铜溶液后,铁和铜构成原电池。铁的金属性强于铜,因此铁是负极失去电子,被还原。铜是正极,溶液中的铜离子得到电子,发生还原反应析出铜。因此是A端比B端低。
(2)①根据方程式Fe+Cu2+=Fe2++Cu可知,铁失去电子被氧化,发生氧化反应,因此铁是负极,溶液中的铜离子得到电子发生还原反应。由于左侧烧杯中盛有硫酸亚铁溶液,所以X电极是铁电极,做负极,C电极是正极,所以电解液Y应该是硫酸铜溶液。
②X电极是铁电极,做负极,发生的电极反应为Fe-2e-=Fe2+。
③由于左侧烧杯中产生亚铁离子,因此要保证溶液的电中性,则盐桥中的阴离子氯离子向向左侧烧杯移动。右侧烧杯中铜离子放电,所以要保证溶液的电中性,在盐桥中的阳离子K+向右侧烧杯移动,A、C、D均不正确,B正确,答案选B。
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,则此时B中铁与铜可以构成原电池,所以电流计指针发生偏转。此时B装置 是原电池,则A装置是电解池。由于A中电极都是铁,而电解质溶液是硫酸亚铁,因此相当于是电镀,溶液的浓度不变。由于铁的金属性强于铜,所以B装置中铁是负极,铜是正极。
(4)把(2)中盐桥改为铜棒,其它不变。由于此时两池都没有可自发进行的氧化还原反应,因此不能构成原电池,所以电流计指针不发生偏转。
本题难度:一般
4、选择题 关于铜电极的叙述中不正确的是
A.铜锌原电池中铜是正极
B.在镀件上镀铜时可用金属铜作阳极
C.用电解法精炼铜时粗铜做阳极
D.用电解法精炼铜时纯铜做阳极
参考答案:D
本题解析:A、原电池中较活泼的电极是负极,较不活泼的电极是正极。锌比铜活泼,则铜锌原电池中铜是正极,锌是负极,A正确;B、电镀是待镀金属作阴极与电源的负极相连。镀层金属是阳极,与电源的正极相连,则在镀件上镀铜时可用金属铜作阳极,B正确;C、粗铜精炼时粗铜做阳极,纯铜做阴极,因此用电解法精炼铜时粗铜做阳极,C正确;D、用电解法精炼铜时纯铜做阴极,D不正确,答案选D。
本题难度:一般
5、选择题 如下图,各烧杯中盛有海水,铁在其中被腐蚀的速度由快到慢的顺序为 (? )
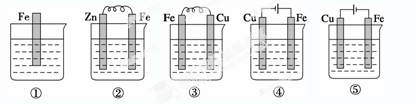
A.①②③④⑤
B.④③②①⑤
C.④③①②⑤
D.④②③①⑤
参考答案:C
本题解析:金属腐蚀快慢的比较规律:电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极,结合题给装置选C
本题难度:一般