微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:
O2(g)?=?O2+(g)+e-?△H1=?+1175.7?kJ/mol
PtF6-(g)?=PtF6(g)+e-?△H2=?+771.1?kJ/mol
O2+(g)+PtF6-(g)?=O2PtF6(s)?△H3=?-482.2?kJ/mol
则反应O2(g)+PtF6(g)?=?O2PtF6(s)的△H是
[? ]
A.77.6?kJ?
B.-77.6?kJ/mol?
C.+77.6kJ/mol?
D.-886.8kJ/mol
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
[? ]
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
B.甲烷燃烧热的热化学方程式CH4(g) + 2O2(g) == CO2(g) +2H2O(g);△H= -Q kJ·mol-1
C.已知:①2H2(g)+O2(g)===2H2O(g);△H=-a kJ·mol-1,②2H2(g)+O2(g)===2H2O(l);△H=-b kJ·mol-1, 则a>b
D.已知:①C(s,石墨)+O2(g)===CO2(g);△H=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)===CO2(g);△H=-395.0 kJ·mol-1,则C(s,石墨)===C(s,金刚石);△H=+1.5 kJ·mol-1
参考答案:A
本题解析:
本题难度:一般
3、选择题 已知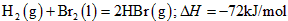 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表
H2
Br2
HBr
1mol分子中的化学键断裂需要吸收的能量/kJ
436
a
369
则表中a为
[? ]
A.404
B.260
C.230
D.200
参考答案:D
本题解析:
本题难度:一般
4、填空题 (1)已知
①CO(g) + 1/2 O2(g) =CO2(g) ΔH1= -283.0 kJ/mol
②H2(g) + 1/2 O2(g) = H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3O2(g) = 2CO2(g) + 3H2O(l) ΔH3=-1370 kJ/mol
试计算④2CO(g)+ 4H2(g)= H2O(l)+C2H5OH(l) 的ΔH4______________
(2)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,镍镉可充电电池中的电解质溶液为KOH溶液,Cd(OH)2、Ni(OH)2、NiO(OH)都难溶于KOH溶液。它的充放电反应按下式进行
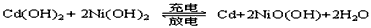
请分别写出该电池在放电及充电时的电极反应式。
____________________________________
参考答案:(1)ΔH4=-339.2 kJ/mol
(2)负极:Cd-2e-+2OH-=Cd(OH)2;正极:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
阳极:2Ni(OH)2+2OH--2e-=2NiO(OH)+2H2O;阴极:Cd(OH)2+2e-=Cd+2OH-
本题解析:
本题难度:一般
5、简答题 请回答下列问题:
(1)现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途.
①已知:2C(s)+O2(g)=2CO(g);△H1,2H2(g)+O2(g)=2H2O(g);△H2.
则反应C(s)+H2O(g)?CO(g)+H2(g);△H=______.(用含△H1、△H2的代数式表示)
②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g);△H3.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol?CO和2mol?H2的混合气体,控温,进行实验,测得相关数据如下图1和图2.
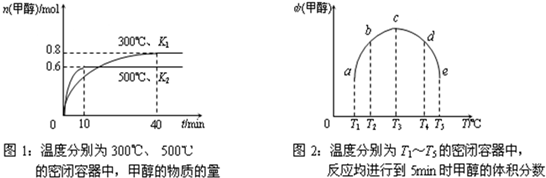
a.该反应的△H3______0(选填“<”、“>”或“=”,下同),K1______K2.
b.将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有______.
(2)某燃料电池以熔融态K2CO3为电解质,一极通入CO,另一极通入空气和CO2的混合气体.已知该燃料电池正极反应为2CO2+O2+4e-=2CO32-;则其负极的电极反应式为______.
(3)图3为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:
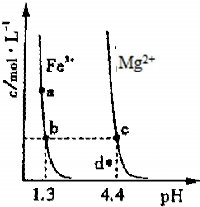
该温度下,溶度积常数的关系为:Ksp[Fe(OH)3]______Ksp[Mg(OH)2]
(填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
______.
参考答案:(1)①2C(s)+O2(g)=2CO(g)△H1? ①
?2H2(g)+O2(g)=2H2O(g)△H2? ②
盖斯定律得①-②得:2C(s)+2H2O(g)?2CO(g)+2H2(g)△H1-△H2,
则反应C(s)+H2O(g)?CO(g)+H2(g)△H=△H1-△H?22,故答案为:△H1-△H?22;
?②a.图1可以看出,甲醇的物质的量为0.6mol的曲线温度大,说明升高温度,甲醇的物质的量减少,即平衡逆向移动,说明正反应是放热反应,所以△H3<0,故答案为:<;
因正反应是放热反应,温度降低,平衡正向移动,平衡常数增大,所以说低温时平衡常数大,故答案为:>;
b.因正反应为放热反应,同时是气体化学计量数减小的反应,所以可通过升温、减压等措施使平衡逆向移动,故答案为:升温、减压;
(2)电池的总反应为:2CO+O2=2CO2,正极反应为2CO2+O2+4e-=2CO32-,所以负极的电极反应式为:CO+CO32--2e-=2CO2,故答案为:CO+CO32--2e-=2CO2,
(3)由b、c两点得:KSP[Fe(OH)3]=c(Fe3+)?(OH-)3=c(Fe3+)?(10-12.7)3,而KSP[Mg(OH)2]=c(Mg2+)?(OH-)2=c(Mg2+)?(10-9.6)2,因c(Fe3+)=c(Mg2+),所以KSP[Fe(OH)3]<KSP[Mg(OH)2],故答案为:<;浊液中存在溶解平衡:Mg(OH)2?Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
本题解析:
本题难度:一般