微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某反应的反应物与生成物有:H3AsO4、K2SO4、KBrO3、H2SO4、AsH3、H2O和一种未知物质X。已知0.2 mol KBrO3在反应中得到1 mol电子,则下列说法不正确的是
A.AsH3是该反应的还原剂
B.X的化学式为Br2
C.根据反应可推知氧化性:KBrO3>H3AsO4
D.氧化剂和还原剂的物质的量之比为2:5
参考答案:D
本题解析:略
本题难度:一般
2、填空题 已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
Cu+2H2SO4(浓)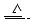 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于?(用字母代号填写)
A.酸 ?B.碱 ?C.盐?D.酸性氧化物 ?E.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中?(填写化学式,下同)失去电子,氧化剂是?。
(2)若A物质通入品红溶液,观察到溶液褪色,说明A物质具有?(填序号,下同);若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有?。
A.氧化性? B.还原性? C.漂白性
若A物质通入双氧水,请大胆判断所得溶液是?(填溶质的化学式)
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为?L (假设气体全部逸出)。若用4 mol·L-1的NaOH溶液吸收生成的A,并生成正盐,写出发生的反应方程式?计算需要NaOH溶液的体积?L。
参考答案:(1)D;SO2;KMnO4?(2)C;A;H2SO4。
(3)2.24;2NaOH + SO2 =Na2SO3 + H2O;0.05
本题解析:(1)铜和浓硫酸反应的化学方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。SO2属于酸性氧化物。因此选项为D。SO2可以使酸性KMnO4溶液褪色,是由于发生反应:2KMnO4+ 5SO2+2H2O=K2SO4+2MnSO4+2H2SO4。在此反应中,SO2失去电子,作还原剂;KMnO4得到电子,作氧化剂,表现氧化性。(2)若SO2通入品红溶液,观察到溶液褪色,是因为SO2有漂白性。若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,是因为发生反应:SO2+H2O=H2SO3. H2SO3+Na2S=Na2SO3+H2S;SO2+2H2S="3S↓+" 2H2O. 说明SO2具有氧化性。若将SO2通入双氧水中,则发生氧化还原反应:SO2+H2O2=H2SO4,产生硫酸。(3)铜和浓硫酸反应的化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O。SO2属于酸性氧化物。因此选项为D。SO2可以使酸性KMnO4溶液褪色,是由于发生反应:2KMnO4+ 5SO2+2H2O=K2SO4+2MnSO4+2H2SO4。在此反应中,SO2失去电子,作还原剂;KMnO4得到电子,作氧化剂,表现氧化性。(2)若SO2通入品红溶液,观察到溶液褪色,是因为SO2有漂白性。若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,是因为发生反应:SO2+H2O=H2SO3. H2SO3+Na2S=Na2SO3+H2S;SO2+2H2S="3S↓+" 2H2O. 说明SO2具有氧化性。若将SO2通入双氧水中,则发生氧化还原反应:SO2+H2O2=H2SO4,产生硫酸。(3)铜和浓硫酸反应的化学方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,在反应方程式中,每产生1mol的SO2气体,电子转移2mol.。现在电子转移了0.2mol,所以产生了0.1mol的SO2气体。在标准状况下,其体积为2.24L。若用4 mol·L-1的NaOH溶液吸收生成的SO2,并生成正盐,则该反应的反应方程式为2NaOH + SO2 =Na2SO3 + H2O。n(NaOH)=2n(SO2)=0.2mol。V(NaOH)=n÷c=0.2mol÷4mol/L=0.05L.2气体的实验室制法、性质及有关反应的计算的知识。
CuSO4+SO2↑+2H2O,在反应方程式中,每产生1mol的SO2气体,电子转移2mol.。现在电子转移了0.2mol,所以产生了0.1mol的SO2气体。在标准状况下,其体积为2.24L。若用4 mol·L-1的NaOH溶液吸收生成的SO2,并生成正盐,则该反应的反应方程式为2NaOH + SO2 =Na2SO3 + H2O。n(NaOH)=2n(SO2)=0.2mol。V(NaOH)=n÷c=0.2mol÷4mol/L=0.05L.2气体的实验室制法、性质及有关反应的计算的知识。
本题难度:一般
3、选择题 某同学用回收的镁铝合金制取氢气.现有l0.8g镁铝合金,下列说法正确的是( )
A.常温下与足量18mol/LH2SO4反应,最多可放出0.6?mol?H2
B.常温下与足量2mol/LHNO3反应,最少可放出0.45?mol?H2
C.常温下与足量2?mol/L?H2SO4反应,放出H2的量在0.45?mol~0.6?mol之间
D.常温下与足量2mol/LNaOH反应,放出H2的量在0.45?mol~0.6?mol之间
参考答案:A、浓硫酸具有强氧化性,铝在浓硫酸中发生钝化,镁与浓硫酸反应生成二氧化硫,不生成氢气,故A错误;
B、稀硝酸是氧化性酸,镁、铝与稀硝酸反应生成一氧化氮气体,不生成氢气,故B错误;
C、2?mol/L?H2SO4为稀硫酸,镁、铝与稀硫酸反应生成氢气,若l0.8g全是镁,根据电子转移守恒,生成氢气物质的量为10.8g24g/mol=0.45mol,若l0.8g全是铝,根据电子转移守恒,生成氢气物质的量为10.8g27g.mol×32=0.6mol,所以放出H2的量在0.45?mol~0.6?mol之间,故C正确;
D、镁与氢氧化钠不反应,铝与氢氧化钠反应生成氢气,若l0.8g全是铝,根据电子转移守恒,生成氢气物质的量为10.8g27g.mol×32=0.6mol,所以放出H2的量在0~0.6?mol之间,故D错误.
故选C.
本题解析:
本题难度:简单
4、选择题 在下列反应中,水是氧化剂的是(? )
A.Cl2 + H2O
B.NO2 + H2O
C.Fe + H2O(g)
D.Na2O2 + H2O
参考答案:C
本题解析:水做氧化剂,由水中的氢得电子,应该放出氢气,在上面的选项中,只有C选项能放出氢气,所以正确答案应该选C。
本题难度:简单
5、填空题 (1)用双线桥标出下列反应的电子转移方向和数目,并填空:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O?
其中氧化剂是______;?还原产物是______.
(2)写出生活中漂白粉漂白原理的化学反应方程式:______.
参考答案:(1)氧化还原反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中失电子的元素是铜元素,化合价升高,得电子的元素是氮元素,化合价降低,转移的电子数目为6mol,电子 转移情况为:

,硝酸是氧化剂,一氧化氮是还原产物;故答案为:

;HNO3;NO;
(2)漂白粉的漂白原理是:次氯酸钙和空气中的二氧化碳、水反应生成的次氯酸具有漂白性,方程式为:Ca(ClO)2+H2O+CO2=CaCO3↓+H2O+CO2↑,故答案为:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO.
本题解析:
本题难度:一般