微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
参考答案:发生反应有:2Al+3H2SO4═Al2(SO4)3+3H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
讨论:(1)若酸碱均过量,则产生的氢气取决于铝,铝的质量相同,所以氢气相等1:1.
(2)若酸碱均不够,产生的氢气取决于酸碱,根据方程式,酸碱产生的比值为2:3
(3)现在的比值是5:6,比值处于 2:3和1:1之间,由于铝消耗硫酸量大于碱,此时铝对于酸过量而对于碱不足,
故选B.
本题解析:
本题难度:简单
2、填空题 有关物质间转化关系如下图,试回答:
 ?
?
(1)转化①的反应条件为? .
(2)转化②的化学方程式为?.转化③的离子方程式为?.
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择?(填名称).
(4)向50 mL 3 mol·L-1 AlCl3溶液中滴加1 mol·L-1 NaOH溶液,结果Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为?或?mL。
参考答案:(1)电解
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑,MnO2+4H++2Cl- Cl2↑+Mn2++2H2O
Cl2↑+Mn2++2H2O
(3)氨水
(4)150ml、550ml
本题解析:
试题解析:(1)由氧化铝制取铝单质,通过电解的方法。
(2)转化②是指铝和氢氧化钠溶液的反应,所以方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,转化③是指二氧化锰与浓盐酸反应制取氯气,所以离子方程式为MnO2+4H++2Cl- Cl2↑+Mn2++2H2O。
Cl2↑+Mn2++2H2O。
(3)因为氢氧化铝易溶解于强碱溶液,所以制备氢氧化铝时常用弱碱溶液氨水。
(4)由题意可知氯化铝的物质的量为0.15mol, Al3+离子有1/3转化为Al(OH) 3时,有两种情况:一、NaOH不足,这时有0.05mol的Al(OH) 3生成则需要NaOH0.15mol,体积为150ml;二、NaOH过量时,生成0.15mol的Al(OH) 3需要0.45mol的NaOH,再溶解0.1mol的Al(OH) 3需要0.1mol的NaOH,所以共需要0.55mol的NaOH,体积为550ml。
本题难度:一般
3、选择题 下列物质中,属于两性氧化物的是:
A.Al
B.Al(OH)3
C.Al2O3
D.SO2
参考答案:C
本题解析:首先,题意为两性氧化物,故A、B项错误;D项SO2为酸性氧化物。故选C项。
点评:本题需要学生熟练掌握铝及铝的化合物的两性,这属于重点知识,要理解记忆。
本题难度:一般
4、填空题 Mg与H2O反应:_______________________
参考答案:Mg+2H2O=Mg(OH)2↓+H2↑
本题解析:
本题难度:简单
5、选择题 镁和铝分别与等浓度、等体积的足量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的( ?)
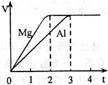
A.物质的量之比为3:2
B.质量之比为3:2
C.转移电子数之比为3:2
D.反应速率之比为2:3
参考答案:A
本题解析:
由图可知,产生氢气的体积相同,氢气的物质的量就形同,转移电子数相等,所以C错
假设都转移1摩尔电子时,镁反应1/2摩尔,铝反应1/3摩尔,物质的量之比为3:2 ,A对,质量比4:3,镁比铝活泼,反应速率之比应大于1,不是小于1.
本题难度:简单