微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 (15分)
某学习小组利用某工业废弃固体(主要成分为Cu2S和Fe2O3)来研究相关物质的制备。设计方案如图所示:

已知:Ksp[Cu(OH)2]=6.0×10-20 ,Ksp[Fe(OH)2]=1.6×10-14 ,Ksp[Fe(OH)3]=1.0×10-38
(1) 废弃固体在空气中灼烧发生反应(有2种元素被氧化)的化学方程式为______。
(2) 溶液C通过_______、_________、过滤等操作得到Fe2(SO4)3晶体。
(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3?+ 2H2O和?。溶液D在这一过程中所起的作用是_______。
(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是??,溶液的pH至少调节为________。
参考答案:(1)Cu2S + 2O2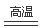 2CuO + SO2?(2)蒸发浓缩;冷却结晶?
2CuO + SO2?(2)蒸发浓缩;冷却结晶?
(3)Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4;催化剂?(4)CuO(或Cu(OH)2、CuCO3等);3
本题解析:(1) 在废弃固体中Fe2O3已经是最高价氧化物,不能再发生反应,而Cu2S在空气中灼烧会发生反应产生SO2和CuO。反应的化学方程式为Cu2S + 2O2 2CuO + SO2 。(2)把灼烧后的固体加入到硫酸中,会发生反应得到Fe2(SO4)3和CuSO4。再加入过量的Fe粉,发生反应:Fe2(SO4)3+Fe=3FeSO4;CuSO4+Fe= Cu+FeSO4。过滤得到的滤液中含有FeSO4。然后加入过量的H2O2,发生反应得到溶液C:Fe2(SO4)3。溶液C通过蒸发浓缩;冷却结晶、过滤等操作得到Fe2(SO4)3晶体。(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3?+ 2H2O和Fe2(SO4)3+Cu = CuSO4+2FeSO4。可见溶液D在这一过程中参加反应,但是最后又变为原来的物质。说明溶液D所起的作用是催化剂。(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中含有CuSO4和FeSO4。加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是 CuO或Cu(OH)2、CuCO3,因为c(Fe3+)·c3(OH-)≥1.0×10-38; c(Fe3+)=10-5 mol/L,所以c3(OH-)≥1.0×10-33. c(OH-)≥1.0×10-11 mol/L;c(H+)≤.0×10-3 mol/L。溶液的pH至少调节为3。
2CuO + SO2 。(2)把灼烧后的固体加入到硫酸中,会发生反应得到Fe2(SO4)3和CuSO4。再加入过量的Fe粉,发生反应:Fe2(SO4)3+Fe=3FeSO4;CuSO4+Fe= Cu+FeSO4。过滤得到的滤液中含有FeSO4。然后加入过量的H2O2,发生反应得到溶液C:Fe2(SO4)3。溶液C通过蒸发浓缩;冷却结晶、过滤等操作得到Fe2(SO4)3晶体。(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3?+ 2H2O和Fe2(SO4)3+Cu = CuSO4+2FeSO4。可见溶液D在这一过程中参加反应,但是最后又变为原来的物质。说明溶液D所起的作用是催化剂。(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中含有CuSO4和FeSO4。加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是 CuO或Cu(OH)2、CuCO3,因为c(Fe3+)·c3(OH-)≥1.0×10-38; c(Fe3+)=10-5 mol/L,所以c3(OH-)≥1.0×10-33. c(OH-)≥1.0×10-11 mol/L;c(H+)≤.0×10-3 mol/L。溶液的pH至少调节为3。
本题难度:一般
2、选择题 下列反应所得溶液中一定只含有一种溶质的是( )
A.向稀硝酸中加入铁粉
B.向Na2CO3溶液中滴加少量的稀盐酸
C.向NaOH溶液中通入CO2气体
D.向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液
参考答案:D
本题解析:
本题难度:简单
3、选择题 向CuO和Fe的混合物中加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,再向滤液中插入一枚铁钉,发现铁钉无任何变化。根据上述现象判断下列结论正确的是
A.不溶物一定是Cu
B.不溶物中一定含有铜,但不一定含有铁
C.不溶物一定是Fe
D.溶液中一定含有Fe2+,但不一定含有Cu2+
参考答案:B
本题解析:
本题学生应明确离子氧化性大小:Cu2+> H+理解氧化还原反应的先后顺序。
溶液中加入硫酸,产生H+发生反应:CuO + 2H+ = Cu2+ + H2O
Fe + 2H+ = Fe2+ + H2O
但由于氧化性大小:Cu2+> H+可得一个总的过程:
CuO + Fe + 2H+ =" Cu" + H2O + Fe2+
直到CuO反应完以后可看作只发生: Fe + 2H+ = Fe2+ + H2O
由于题中说:可知一定有铜固体;而硫酸是一定量的,加入铁钉无任何变化。所以溶液无铜离子,硫酸也无剩余。
本题难度:简单
4、选择题 等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
A.FeO
B.Fe2O3
C.FeSO4
D.Fe3O4
参考答案:A
本题解析:根据化学式可算出四种物质中+2价Fe含量最大的是FeO,所以等质量的四种物质与足量稀硝酸反应,放出NO物质的量最多的是FeO,故A项正确。
本题难度:一般
5、计算题 在铁和氧化铁的混合物15g中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH溶液200mL。求:
①混合物中铁和氧化铁各多少克?
②稀H2SO4的物质的量浓度为多少?
参考答案:(1)混合物中铁是7g,氧化铁是8g。(2)稀H2SO4的物质的量浓度为2 mol·L-1。
本题解析:(1)设铁和氧化铁的物质的量分别为x和y,则
x×56g/mol+y×160 g/mol=15g……………①
由得失电子守恒得,x×2=y×2+1.68L/22.4L/mol×2……………②
解得:x=0.25mol, y=0.05mol.即m(Fe)=0.25mol×56g/mol=7g, m(Fe2O3)=0.05mo l×160g/mol=8g
(2)在铁和氧化铁的混合物中加入稀H2SO4反应停止后,溶液中的溶质主要是H2SO4和FeSO4。
由电荷守恒知:硫酸中的硫酸根离子最后完全和钠离子结合在一起。
n(H2SO4)=1/2×3 mol/L×0.2L=0.3mol
c(H2SO4)=0.3 mol/0.15L=2 mol·L-1
本题难度:简单