微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列推断正确的是
A.根据同浓度两元素含氧酸钠盐(正盐)溶液的碱性强弱,可判断其非金属性的强弱
B.根据同主族两非金属元素氢化物沸点高低,可判断其非金属性的强弱
C.根据相同条 件下两主族金属单质与水反应的难易,可判断其金属性的强弱
件下两主族金属单质与水反应的难易,可判断其金属性的强弱
D.根据两主族金属原子最外层电子数的多少,可判断其金属性的强弱
参考答案:C
本题解析:略
本题难度:一般
2、选择题 类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论。因此,推出的结论最终要经过实践的检验才能决定其是否正确。以下几种类推结论中,正确的是
A.金属镁失火不能用二氧化碳灭火器灭火;金属钠失火也不能用二氧化碳灭火
B.Fe3O4可以写成FeO·Fe2O3;Pb3O4也可以写成PbO·Pb2O3
C.不能电解熔融AlCl3来制取金属铝;也不能电解熔融MgCl2来制取金属镁
D.Al与S直接化合时可得到Al2S3;Fe与S直接化合时也可得到Fe2S3
参考答案:A
本题解析:A正确;B错,Pb3O4也可以写成2PbO·PbO2;C错,能用电解熔融MgCl2来制取金属镁;D错,Fe与S直接化合时也可得到FeS
本题难度:一般
3、选择题 下列叙述正确的是( )
A.SO2具有还原性,故可作漂白剂
B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硝酸中的HNO3见光易分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在Cl2中燃烧生成FeCl3,故在与其他金属反应的产物中的Fe也显+3价
参考答案:A、SO2具有还原性和氧化性,在作漂白剂时并不发生氧化还原反应,而是与品红中的有色物质发生化合而褪色,故A错误;
B、Na是活泼金属,Na与MgCl2溶液反应时,先与水反应得到H2,可采用电解熔融的氯化镁来制取镁,故B错误;
C、浓硝酸不稳定,见光分解,生成二氧化氮红棕色气体,有时在实验室看到的浓硝酸呈黄色,就是硝酸分解产生的二氧化氮溶于硝酸的缘故,故C正确;
D、Fe与其它非金属反应的产物的化合价取决于非金属的氧化性强弱,并不一定是+3价,如与S反应生成FeS中Fe显+2价,故D错误.
故选C.
本题解析:
本题难度:简单
4、选择题 一定量 Fe和 Fe2O3的混合物投入250 mL 2 mol/L HNO3溶液中,固体完全溶解后,生成1.12 L(标准状况) NO (HNO3的还原产物假定仅此一种)再向反应后的溶液中加1 mol/L NaOH 溶液,要使铁元素完全沉淀下来,所加入的NaOH溶液的体积最少是? (? )
A.450 mL
B.500 mL
C.400 mL
D.无法确定
参考答案:A
本题解析:略
本题难度:简单
5、选择题 在冶金工业上,均不能用通常化学还原剂制得的金属组是( )。
A.Na,Mg,Al
B.Na,K,Zn,Fe
C.Zn,Fe,Cu,Ag
D.Mg,Al,Zn,Fe
参考答案:A
本题解析:根据金属的活动性顺序有下列冶炼方法:①从K~Al,用电解法;②Zn~Cu用还原剂(如H2,CO等)还原法;③Hg和Ag用加热分解法2HgO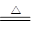 2Hg+O2↑。
2Hg+O2↑。
本题难度:简单