微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 H2O2、CH3COOH是生活中常见的物质,在化学研究中应用广泛。
(1)某小组拟在Fe3+的催化下,探究H2O2分解速率影响的某一因素。限选试剂与仪器:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
将表中所给的混合溶液分别加入到2个同容积的锥形瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
锥形瓶编号
| 30% H2O2/mL
| 0.1mol?L-1Fe2(SO4)3/mL
| 蒸馏水/mL
| 反应温度/℃
|
1
| 10
| 1
| 0
| 30
|
2
| Vx
| 1
| 5
| 30
|
表中Vx= mL,实验目的是 。
(2)醋酸和盐酸是化学实验中常见的二种一元酸,某小组设计下列实验证明它们的电离程度。
实验一:室温下,测出0.1mol?L-1醋酸和盐酸pH值分别为3、1。提示:pH=-lgc(H+)
结论一:醋酸在水溶液中电离 (填“完全”、 “不完全”)。该温度下醋酸的电离度为 ;写出醋酸的电离方程式
实验二:现取等体积、浓度均为1mol?L-1醋酸和盐酸分别加入经砂纸打磨过的表面积相同的镁条。观察放出氢气速率的快慢。
结论二:其它条件相同时,同浓度同体积的一元酸与金属反应时,反应 (填“快”或“慢”)的为弱电解质
参考答案:(1)5,探究H2O2的浓度对分解速率影响
(2)不完全;1%(不写百分数扣1分);CH3COOH CH3COO-+H+;慢
CH3COO-+H+;慢
本题解析:据题意可知表1主要探讨H2O2的浓度对分解速率影响,因此加的双氧水的体积为5ml.醋酸属于弱酸,不能完全电离。而电离度(α)= (已电离弱电解质分子数/原弱电解质分子数)*100%,由此可知该温度下醋酸的电离度为1%。取等体积、浓度均为1mol?L-1醋酸和盐酸,弱电解质电离出来的氢离子浓度比盐酸的小,因此与金属反应的反应速率比较慢。
考点:主要考查影响化学反应速率因素以及弱电解质电离的相关知识点。
本题难度:困难
2、填空题 回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO42-和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为??。
(2)液氨类似于水的电离,试写出液氨的电离方程式?;
(3)下列离子方程式书写正确的是?。?
A.石灰乳与Na2CO3溶液混合:Ca2++CO32—=====CaCO3↓?
B.NH4HSO3溶液与足量的NaOH溶液混合加热:
NH4+ + HSO3- +2OH-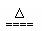 NH3↑+SO32-? +2H2O?
NH3↑+SO32-? +2H2O?
C.酸性条件下KIO3溶液 与KI溶液反应生成I2: IO32-? +5I-+3H2O====3I2+6OH-
D.AgNO3溶液中加入过量氨水:Ag++NH3·H2O=====AgOH↓+NH4+?
E.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-="====" BaSO4↓+H2O?
F.CuSO4溶液吸收H2S气体:Cu2++H2S======CuS↓+2H+?
G.AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O ="====" AlO2-? +4NH 4+ +2H2O
H.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
Ba2++2OH-+NH4+? +HCO3-="==?" BaCO3↓+NH3·H2O+H2O
I.LiAlH4溶于适量水后得到无色溶液,则化学方程式可表示为:
LiAlH4+2H2O ="==LiAlO2" +4H2↑
(4) Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为?。?
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为?。?
A.3∶2∶1? B.2∶4∶1?C.2∶3∶1? D.4∶2∶1
参考答案:(1) 3
(2) H2O + NH4+  ?NH3·H2O + H+?
?NH3·H2O + H+?
(3) B、H、I、F?
(4)B
本题解析:略
本题难度:一般
3、选择题 醋酸溶液中存在电离平衡:CH3COOH?H++CH3COO-,下列叙述正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(CH3COO-)
B.0.10mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量的CH3COONa固体,溶液中c(H+)减小
D.常温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH=7
参考答案:A.醋酸溶液中,氢离子包含醋酸电离和水电离的氢离子,醋酸根离子只有醋酸电离的,所以导致溶液中c(H+)>c(CH3COO-),故A错误;
B.加水稀释醋酸溶液,能促进醋酸电离,溶液中氢离子浓度减小,温度不变,水的离子积常数不变,导致溶液中c(OH-)增大,故B错误;
C.加入少量CH3COONa固体,由电离平衡可知,c(CH3COO-)增大,抑制醋酸电离,所以溶液中c(H+)减小,故C正确;
D.常温下,pH=3的CH3COOH溶液中醋酸浓度大于10-3 mol/L,pH=11的NaOH溶液中氢氧化钠浓度等于10-3 mol/L,等体积混合时,导致酸过量,则溶液呈酸性,pH<7,故D错误;
故选C.
本题解析:
本题难度:简单
4、填空题 Al( OH)3的电离方程式可表示为:H2O+AlO2-+ H+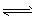 Al(OH)3
Al(OH)3 Al3+ +3OH-。 试根据平衡移动原理,解释下列有关问题。
Al3+ +3OH-。 试根据平衡移动原理,解释下列有关问题。
(1)向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是________,有关离子方程式为____。
(2)向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是____, 有关离子方程式为________。
参考答案:(1)盐酸中的H+与OH-结合生成水,使平衡中 c(OH-)减小,平衡向右移动,Al( OH)3沉淀不断溶解 ;Al(OH)3 +3H+=Al3+ +3H2O
(2)苛性钠溶液中OH -结合 H+生成水,使上述平衡中c(H+)减小,平衡向左移动,Al( OH)3 沉淀不断溶解; AI(OH)3+OH-=AlO2-+2H2O
本题解析:
本题难度:一般
5、选择题 25 ℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是
A.中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积
B.往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全
C.将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-)
D.25℃时pH=3的盐酸、pH=3的醋酸溶液中水电离出的c(H+)均为10-11 mol·L-1