| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《热化学方程式》高频试题特训(2017年最新版)(八)
参考答案:B 本题解析:(1)×2-(3)得C2H4(g)+2H2(g) 本题难度:一般 2、填空题 (13分)X、Y、Z、W四种常见元素,其相关信息如下表:
(2)用“>”或“<”填空。
(4)查阅资料知道: 4Y(s)+3O2(g)=2Y2O3(s) △H=-3351.4 kJ.mol-1 3W(s)+2O2(g)=W3O4(s) △H=-1120 kJ.mol-1 则Y与W3O4反应的热化学方程式是: 。 参考答案:(1)四 VIII [Ar]3d6或者1S22S2S2P63S23P63d6(各1分) 本题解析:由题意可知X为N元素,Y为Al元素,Z为Si元素,W为Fe元素;(1)W位于周期表的第四周期,第VIII族;(2)离子半径:N>Al;电负性:Si>Fe;第一电离能:N>Si;单质熔点:N2<Fe;(3)X2、碳和Z的氧化物在1300℃时可合成Z3X4。写出该反应化学方程式:2N2+3SiO2+6C=Si3N4+6CO↑;Z3X4是一种耐高温的结构陶瓷材料,是共价化合物,原子晶体;(4)由盖斯定律可知:Y与W3O4反应的热化学方程式是:Fe3O4(s)=4Al2O3(s)+9Fe(s) △H=-3342.8 kJ.mol-1。 本题难度:一般 3、填空题 (13分)碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。 参考答案:(1)①SO2、CO2、O2(2分) ②——1Fe3O4+3SO2(2分) 本题解析: (1)①钢样中的碳、硫在装置A中被氧化为CO2、SO2,故a的成分为CO2、SO2以及未反应的O2;②FeS中的,-2价的硫被氧化为SO2,+2价的Fe被氧化为+3价的铁,结合所给化学计量数,可知产物应为Fe3O4和SO2,故方程式为3FeS+5O2=Fe3O4+3SO2。(2)①H2O2具有氧化性,可氧化SO2使S的化合价升高为+6价,在溶液中反应产物应为硫酸,故反应方程式为:H2O2+SO2=H2SO4;②1mL NaOH相当于yg S,故z mL NaOH相当于 zy g S,则该样品中硫的质量分数为(yz)/x×100%。(3)①碳的燃烧热化学方程式为C(s)+O2(g)=CO2(g) ΔH2=-f kJ·mol-1,根据盖斯定律,三个方程式进行加和,3式-1式÷2-2式÷2,得出ΔH=0.5d+0.5e-f kJ·mol-1,所以写热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=0.5d+0.5e-f kJ·mol-1;②碳酸钾吸收二氧化硫生成亚硫酸钾,又与硫酸反应生成二氧化硫和硫酸钾,硫酸钾可以做化肥,氨水可以吸收二氧化硫,转化为亚硫酸铵,与硫酸反应生成二氧化硫和硫酸铵,硫酸铵可以做氮肥,故选ce。 本题难度:困难 4、选择题 已知下列热化学方程式:Zn(s)+1/2O2(g)=ZnO(s);△H=-351.1kJ·mol-1 |
参考答案:D
本题解析:考查反应热的计算
由①—②式可得到:Zn(s)+HgO(s)=ZnO(s)+ Hg(l) △H=-260.4 kJ·mol-1
答案为D
本题难度:一般
5、选择题 已知在25℃,101kPa下,1g辛烷C8H18燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
[? ]
A.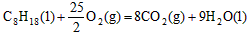 ;△H=-5518kJ/mol
;△H=-5518kJ/mol
B.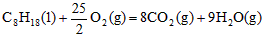 ;△H=-48.40kJ/mol
;△H=-48.40kJ/mol
C.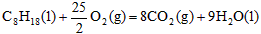 ;△H=+5518kJ/mol
;△H=+5518kJ/mol
D.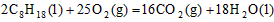 ;△H=+11036kJ/mol
;△H=+11036kJ/mol
参考答案:A
本题解析:
本题难度:简单
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学试题《弱电解质电离平衡.. | ||