微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列根据反应原理设计的应用,不正确的是(?)
A.CO32- + H2O  HCO3-+ OH-热的纯碱溶液清洗油污
HCO3-+ OH-热的纯碱溶液清洗油污
B.Al3+ + 3H2O  Al(OH)3 + 3H+明矾净水
Al(OH)3 + 3H+明矾净水
C.TiCl4+ (x+2)H2O(过量) TiO2·x H2O↓ + 4HCl用TiCl4制备TiO2
TiO2·x H2O↓ + 4HCl用TiCl4制备TiO2
D.SnCl2 + H2O  Sn(OH)Cl↓ + HCl配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓ + HCl配制氯化亚锡溶液时加入氢氧化钠
参考答案:D
本题解析:配制氯化亚锡溶液时加入氢氧化钠会使平衡正向移动而得不到氯化亚锡溶液,D项错误,其他选项均正确。答案选D。
点评:改变影响平衡移动的一个因素,平衡总是向减弱这种改变的方向移动。
本题难度:一般
2、填空题 下图为常温下向25mL 0.1 mol·L-1 MOH溶液中逐滴滴加0.2 mol·L-1HA溶液过程中溶液pH的变化曲线。
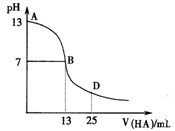
回答下列问题:
(1)上图能确定MOH为?(“强”或“弱”)碱,
理由是?。
(2)上图能确定HA为?(“强”或“弱”)酸,
理由是?。
(3)在D点时,溶液中c(A-)+c(HA)?2c(M+)。(填“>”、“<”或“=”)
参考答案:(1)强(2分);常温条件下水的离子积常数为10-14,0.1 mol·L-1 MOH溶液的pH=13,说明为强碱。(3分)
(2)弱(2分);若HA为强酸则在pH=7是刚好完全反应,体积消耗HA12.5mL,而现在是13ml,说明生成的强碱弱酸盐。(3分)
(3)=(3分)
本题解析:略
本题难度:一般
3、选择题 25 ℃时,在20 mL的盐酸中,逐滴加入0.2 mol·L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是
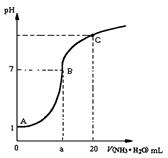
A.滴加前盐酸的物质的量浓度为0.1 mol·L-1
B.B点的横坐标a=10
C.A、B间的任一点,溶液都有c(Cl-)>c(NH4+)> c (H+)> c(OH-)
D.如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH
参考答案:A
本题解析:略
本题难度:一般
4、选择题 下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂;
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂;
③草木灰与铵态氮肥不能混合施用;
④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞;
⑤加热蒸干AlCl3溶液得到Al(OH)3固体。
A.①②③
B.②③④
C.①④⑤
D.①②③④⑤
参考答案:D
本题解析:考查盐类水解的应用。①中水解都显酸性,能除去铁锈,正确。②中前者水解显碱性,后者水解显酸性,相互促进,产生大量的CO2气体,正确。碳酸钠水解显碱性,所以容易使玻璃塞和瓶口黏合在一起,而不易打开,④正确。氯化铝水解生成氯化氢和氢氧化铝,应用水解吸热,且氯化氢易挥发,所以蒸干弱于得到的是氢氧化铝,⑤正确。所以答案选D。
本题难度:简单
5、选择题 下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污
B.稀醋酸溶液加热时其pH 减小
C.小苏打溶液与AlCl3溶液混合产生气体和沉淀
D.浓的硫化钠溶液有臭味
参考答案:B
本题解析:A.纯碱Na2CO3是强碱弱酸盐,水解使溶液显碱性。而油污属于酯,在碱性条件下水解得到高级脂肪酸钠与甘油等容易溶解于水的物质。因此纯碱溶液能够去油污。错误。B.醋酸是弱酸,,电离需要吸收热量。升高温度,促进醋酸的电离。使溶液的酸性增强,其pH 减小。但是这与盐类水解无关。正确。C.小苏打NaHCO3是强碱弱酸盐,水解使溶液显碱性;而AlCl3是强酸弱碱盐,水解使溶液酸性,二者混合,发生双水解反应产生CO2气体和Al(OH)3沉淀.与盐的水解有关。错误。D.浓的硫化钠是强碱弱酸盐,水解产生H2S。浓度大,水解产生H2S多,所以溶液会逸出H2S的臭鸡蛋的臭味。
本题难度:一般