微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在相同条件下,H2和CO的混合气体aL,完全燃烧时消耗相同条件下的O2bL.则a与b的关系正确的是( )
A.a=b
B.a=2b
C.a=0.5b
D.a=3b
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列表达方式正确的是?(?)?
A?氯化氢分子的电子式:H+[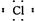 ]-? B 氨气的电子式
]-? B 氨气的电子式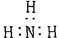
C? O-18原子的符号: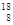 O? D? CO2分子的结构式:O-C-O
O? D? CO2分子的结构式:O-C-O
参考答案:C
本题解析:考查化学用语的书写。氯化氢是由共价键构成的共价化合物,电子式为 。氨气中的氮原子还有1对电子没有参与成键,正确的电子式为
。氨气中的氮原子还有1对电子没有参与成键,正确的电子式为 。在CO2分子中碳原子和氧原子形成的是双键,所以结构式为
。在CO2分子中碳原子和氧原子形成的是双键,所以结构式为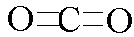 ,所以正确的答案是C。
,所以正确的答案是C。
本题难度:简单
3、简答题 0.2molNa与足量的水反应,生成的NaOH的物质的量是多少?生成的气体的体积在标准状况下是多少L?
参考答案:设生成的NaOH的物质的量为n(NaOH),生成的氢气为V(H2),
? 2Na+2H2O=2NaOH+H2↑
?2mol? 2mol? 22.4L
0.2mol?n(NaOH)?V(H2)?
根据方程式可知:n(NaOH)=0.2mol,
V(H2)=2.24L,
答:生成的NaOH的物质的量是0.2mol,生成的气体的体积在标准状况下是2.24L.
本题解析:
本题难度:一般
4、填空题 向橙色的溴水中通入SO2气体,观察到的现象是____________。有关的离子方程式为___________________________
参考答案:
本题解析:略
本题难度:一般
5、简答题 臭氧(O3)能与KI溶液反应,生成O2等.在反应后的溶液中滴入酚酞变为红色,若滴入淀粉则变为蓝色.为测定某环境空气中的臭氧含量,将0℃、1.01×105Pa的空气33.6m3通过KI溶液,使之完全反应,所得溶液用0.0100mol-L-1的Na2S2O3溶液60.0mL恰好滴定达终点.反应方程式为:2Na2S2O3+I2=Na2S4O6+2NaI.
(1)臭氧通入KI溶液中的化学方程式:______;
(2)滴定过程中选择的指示剂是______,达到滴定终点时的现象为______;
(3)计算该空气中臭氧的体积分数.
参考答案:(1)O3与KI、水反应生成I2、KOH、O2,反应方程式为O3+2KI+H2O=I2+2KOH+O2.
故答案为:O3+2KI+H2O=I2+2KOH+O2;
(2)碘遇淀粉变蓝色,故选择淀粉作指示剂,当溶液由蓝色变为无色,且半分钟颜色不再变化说明滴定到达终点.
故答案为:淀粉;溶液由蓝色变为无色;
(3)由化学方程式得:
O3~~~~~~~~I2~~~~~~2Na2S2O3
1mol? 2mol?
n(O3)? ?0.0100mol/L×0.0600L
所以n(O3)=0.0100mol/L×0.0600L×1mol2mol=0.000300mol
则大气中臭氧的体积分数为:0.000300mol×22.4L/mol33600L×100%=2×10-5%.
答:大气中臭氧的体积分数为2×10-5%.
本题解析:
本题难度:一般