微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列计算结果正确是( )
A.标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内氨水的物质的量的浓度为(
)mol/L
B.标准状况下,将64g?铜片投入到100ml?18?mol/L的浓硫酸中加热会产生22.4?L的SO2气体
C.向1mol的碳酸钾固体中缓缓滴加少量的稀盐酸会产生1mol的CO2气体
D.向含有1mol?Ba(OH)2溶液中通入1molCO2气体就会产生1mol?Ba(HCO3)2的白色沉淀
参考答案:A、令烧瓶的容积为VL,则氨气的体积为VL,氨气的物质的量为VL22.4L/mol=V22.4mol,氨水溶液的物质的量浓度为V22.4molVL=122.4mol/L,故A正确;
B、发生反应Cu+2H2SO4?△?.?CuSO4+SO2↑+2H2O,64g铜的物质的量为1mol,硫酸的物质的量为0.1L×18mol/L=0.18mol,由方程式可知,硫酸不足量,且随反应进行浓硫酸变为稀硫酸,铜与稀硫酸不反应,故1mol铜不能完全反应,生成的SO2气体小于1mol,体积小于22.4L,故B错误;
C、向1mol的碳酸钾固体中缓缓滴加少量的稀盐酸,首先反应生成碳酸氢钾,碳酸钾反应完毕,盐酸在于碳酸氢钾反应生成二氧化碳,是否生成二氧化碳及二氧化碳体积多少,与盐酸的量有关,故C错误;
D、1mol?Ba(OH)2溶液中通入1molCO2气体,前后反应生成1mol?BaCO3白色沉淀,故D错误;
故选A.
本题解析:
本题难度:一般
2、选择题 将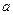 mol钠和
mol钠和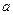 mol铝一同投入
mol铝一同投入 g足量水中,所得溶液密度为
g足量水中,所得溶液密度为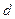 g·mL-1,该溶液中溶质质量分数为
g·mL-1,该溶液中溶质质量分数为
参考答案:C
本题解析:略
本题难度:一般
3、填空题 (12分)酸浸法制取硫酸铜的流程示意图如下

(1)步骤①中Cu2(OH)2CO3发生反应的化学方程式为 。
(2)在步骤③发生的反应中,1mol MnO2转移2mol 电子,该反应的离子方程式为 。
(3)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取4.800 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
b.量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定
(反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
c.量取25.00 mL溶液A,加入足量的NaOH溶液充分反应后,过滤、洗涤、灼烧得红色粉末0.600g。
d.另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165 g。
①用Na2S2O3溶液进行滴定时,滴定到终点的颜色变化为 。
②通过计算确定黄铵铁矾的化学式(写出计算过程)。
参考答案:(共12分)
(1)Cu2(OH)2CO3+2H2SO4====2CuSO4+CO2↑+3H2O
(2)MnO2+2Fe2++4H+====Mn2++2Fe3++2H2O
(3)①滴入最后一滴Na2S2O3溶液时,溶液蓝色恰好褪去,且半分钟内不再恢复到原来颜色
②n(Fe3+)=2n(I2) =n(Na2S2O3)="0.2500" mol·L-1×30.00 mL×10-3 L·mL-1=7.50×10-3 mol
n(Fe3+)=2(Fe2O3)=2×0.600g/160g·mol-1=7.50×10-3 mol
n(SO42-)="1.165" g ÷233 g·mol-1=5.00×10-3 mol
100 mL溶液中含有n(Fe3+)="0.03" mol,n(SO42-)="0.02" mol (2分)
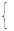 4.800-0.03×56-0.02×96=n(NH4+)×18+n(OH-)×17
4.800-0.03×56-0.02×96=n(NH4+)×18+n(OH-)×17
0.03×3+ n(NH4+)=2×0.02+n(OH-)
n(NH4+)="0.01" mol,n(OH-)="0.06" mol (2分)
x∶y∶m∶n=n(NH4+)∶n(Fe3+)∶n(SO42-)∶n(OH-)=1∶3∶2∶6
化学式为NH4Fe3(SO4)2(OH)6 (2分)
本题解析:(1)步骤①中Cu2(OH)2CO3与硫酸反应生成硫酸铜、水、二氧化碳,化学方程式为Cu2(OH)2CO3+2H2SO4====2CuSO4+CO2↑+3H2O;
(2)在步骤③发生的反应中,二氧化锰与亚铁离子发生氧化还原反应,1mol MnO2转移2mol 电子,则Mn元素的化合价降低2价,生成锰离子,Fe元素的化合价升高到+3价,则离子方程式为MnO2+2Fe2++4H+====Mn2++2Fe3++2H2O;
(3)①碘使淀粉变蓝色,所以开始溶液为蓝色,滴入Na2S2O3溶液,溶液的蓝色逐渐褪去,滴入最后一滴Na2S2O3溶液时,溶液蓝色恰好褪去,且半分钟内不再恢复到原来颜色;
②加入足量的KI则铁离子与碘离子反应生成碘单质,再与Na2S2O3溶液发生氧化还原反应,所以2Fe3+~I2~2Na2S2O3,则n(Fe3+)=2n(I2) =n(Na2S2O3)="0.2500" mol·L-1×30.00 mL×10-3 L·mL-1=7.50×10-3 mol;红色粉末为氧化铁,则n(Fe3+)=2(Fe2O3)=2×0.600g/160g·mol-1=7.50×10-3 mol;与氯化钡溶液反应产生硫酸钡沉淀,则n(SO42-)="1.165" g ÷233 g·mol-1=5.00×10-3 mol;
则100 mL溶液中含有n(Fe3+)= 7.50×10-3mol×4=" 0.03" mol,n(SO42-)= 5.00×10-3 mol×4=" 0.02" mol ,根据质量守恒和正负化合价代数和为0,得
4.800-0.03×56-0.02×96=n(NH4+)×18+n(OH-)×17
0.03×3+ n(NH4+)=2×0.02+n(OH-)
解得 n(NH4+)="0.01" mol,n(OH-)="0.06" mol
x∶y∶m∶n=n(NH4+)∶n(Fe3+)∶n(SO42-)∶n(OH-)=1∶3∶2∶6
化学式为NH4Fe3(SO4)2(OH)6 。
考点:考查对流程的分析,方程式的书写,物质化学式的计算
本题难度:困难
4、选择题 设空气中O2体积分数0.25,N2体积分数0.75.有水存在的条件下,氮的氧化物和一定量空气混合恰好完全反应,反应后气体体积减少一半.该氮的氧化物是( )
A.NO
B.NO2
C.NO和NO2物质的量之比为2:1混合物
D.NO和NO2物质的量之比为1:1混合物
参考答案:混合气体全部与空气中的氧气反应,没有物质是过量的,最终氮的氧化物与氧气、水反应生成HNO3,反应后气体体积减少一半,剩余气体为氮气,令剩余氮气为0.75mol,则氮的氧化物为1.5mol-0.75mol-0.25mol=0.5mol,
结合选项令氮的氧化物的平均组成为NOx,根据电子转移守恒,则:(5-2x)×0.5=0.25×4,解得x=1.5,故氮的氧化物为NO和NO2的混合物,
令NO和NO2的物质的量分别为amol、bmol,则:
本题解析:
本题难度:简单
5、选择题 下列有关化学用语的表示方法中正确的是(?)
A.氯元素的原子结构示意图: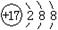
B.N2的结构式:N≡N
C.原子核内有8个中子的氧原子: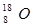
D.二氧化碳的电子式: 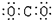
参考答案:B
本题解析:氯元素的最外层电子数是7个,A不正确;原子核内有8个中子的氧原子是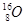 ,C不正确;CO2的电子式是
,C不正确;CO2的电子式是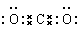 ,D不正确,答案选B。
,D不正确,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。
本题难度:一般