微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
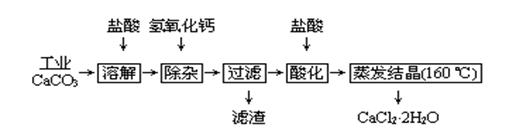
1、实验题 医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为:
已知:查阅资料得知氢氧化物沉淀时的pH为:
氢氧化物
| Fe(OH)3
| Al(OH)3
|
开始沉淀时的pH
| 2.3
| 4.0
| 开始溶解:7.8
|
完全沉淀时的pH
| 3.7
| 5.2
| 完全溶解:10.8
|
?
(1)CaCO3与盐酸反应的离子方程式?。
(2)除杂操作是加入氢氧化钙,调节溶液的pH为?,目的是除去溶液中少量的Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是?
?。
(3)过滤时需用的玻璃仪器有?。滤渣主要成分的化学式?。
(4)酸化时加盐酸的目的为:①?,②防止Ca2+ 在蒸发时发生水解。
(5)为什么蒸发结晶要保持在160℃:?。
(6)测定晶体样品的纯度:若用一定浓度的AgNO3溶液滴定一定质量的晶体样品,所测样品中CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为?。
参考答案:(16分,每空2分)
(1)CaCO3+2H+=Ca2++CO2↑+H2O
(2)5.2~7.8(或之间的任意值、5.2≤pH<7.8)?静置,取少量上层清液于小试管中,滴加KSCN溶液,若不显红色,则Fe(OH)3沉淀完全;反之,则Fe(OH)3沉淀不完全
(3) 烧杯、玻璃棒、普通漏斗? Fe(OH)3、Al(OH)3
(4)除去过量的氢氧化钙(或防止氢氧化钙吸收空气中的二氧化碳,防止钙离子水解等,合理则给分)
(5)温度太高CaCl2 ·2H2O会失水
(6) Na+没除去析出NaCl,导致测定结果偏高(或少量CaCl2 ·2H2O失水)
本题解析:(1)盐酸是强酸,酸性比碳酸强,则难溶于水的碳酸钙易溶于盐酸,生成可溶性的氯化钙、二氧化碳气体和水,将易溶且易电离的化合物改写成离子形式,其余物质都保留化学式,删去实际上未反应的离子,则该反应为CaCO3+2H+=Ca2++CO2↑+H2O;(2)根据表中氢氧化物完全沉淀时的pH可知,除去溶液中少量铁离子和铝离子应使溶液pH介于5.2~7.8之间或者5.2≤pH<7.8,低于3.7时铁离子不能完全变为氢氧化铁沉淀,低于5.2时铝离子不能完全变为氢氧化铝沉淀,高于7.8时,氢氧化铝开始变为偏铝酸根离子,溶液又引入新的杂质;检验氢氧化铁是否沉淀的方法就是检验溶液中是否存在铁离子,由于铁离子遇KSCN溶液变红的特征反应,通常设计的实验方案为:静置,取少量上层清液于小试管中,滴加KSCN溶液,若不显红色,则Fe(OH)3沉淀完全,反之,则Fe(OH)3沉淀不完全;(3)过滤属于化学实验基本操作,也是混合物分离与提纯的常用方法,主要使用烧杯、玻璃棒、普通漏斗等仪器;当溶液pH介于5.2~7.8之间时,铁离子、铝离子完全变为氢氧化铁沉淀、氢氧化铝沉淀,则过滤所得滤渣的成分为Fe(OH)3、Al(OH)3;(4)氢氧化钙是除杂试剂,除杂试剂一定过量,氢氧化钙是强碱,由于目标产物是氯化钙,则酸化时加入盐酸的目的是除去过量的氢氧化钙,将其转化为氯化钙,防止氢氧化钙吸收空气中的二氧化碳,且过量的盐酸受热易挥发逸出(逸出的氯化氢气体可循环利用),不能加硝酸或硫酸酸化,因为它们除去旧杂质时会引入硝酸根离子或硫酸根离子等新杂质;(5)结晶水化合物受热可能失去结晶水,蒸发结晶要控制温度在160℃的原因是,温度太高,二水合氯化钙会失去结晶水;(6)滴定原理为:Ag++Cl-=AgCl↓,若氯离子的物质的量偏大,则测定结果偏高;酸化后所得溶液主要含有氯化钙、氯化钠、氯化氢,蒸发结晶时逸出氯化氢,但是没有除去钠离子,则所得晶体是二水合氯化钙和氯化钠的混合物,氯元素的质量分数:CaCl2>NaCl> CaCl2?H2O >CaCl2?2H2O,因此晶体样品中含有NaCl或二水合氯化钙失去全部或部分结晶水得到的CaCl2或CaCl2?H2O,都能导致所含氯元素的质量分数偏高,则所测样品二水合氯化钙的质量分数偏高。
本题难度:困难
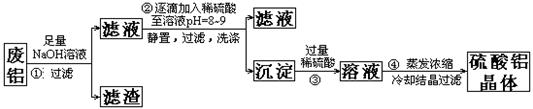
2、实验题 (15分)某化学兴趣小组以含铁的废铝为原料制备硫酸铝晶体,设计如下的实验方案:
请回答以下问题:
(1)上述实验中多次用到过滤操作,该操作中要用到的玻璃仪器有?;
(2)步骤②中有洗涤沉淀的操作,如何判断沉淀已洗涤干净:?
?;
(3)评价步骤②的操作中难以控制之处?,请你提出一个合理而比较容易操作的实验方案(药品可任选)?
?;
(4)步骤①中使用的NaOH溶液以4mol/L为宜。某同学称量mgNaOH固体配制
V m L 4mol/L的NaOH溶液,下面是该同学配制过程的示意图,其操作中错误的是(填操作序号)?。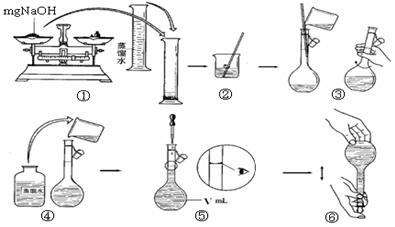
参考答案:(15分)(1)烧杯、漏斗、玻璃棒;(2)取最后一次洗涤液,加入几滴BaCl2溶液,若无白色沉淀生成则洗涤干净;(3)使溶液的p H=8~9难以控制,通入过量CO2气体;
(4)①④⑤(每空各3分)(15分)(1)烧杯、漏斗、玻璃棒;(2)取最后一次洗涤液,加入几滴BaCl2溶液,若无白色沉淀生成则洗涤干净;(3)使溶液的p H=8~9难以控制,通入过量CO2气体;
(4)①④⑤(每空各3分)
本题解析:略
本题难度:简单
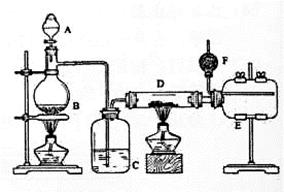
3、实验题 无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为: 2Al+ 6HCl(g) → 2A1Cl3 + 3H2。
完成下列填空:
(1)写出烧瓶中(B处)发生反应的化学方程式:_____________
(2)C中盛有的试剂为_____。进行实验时应先点燃_____(选填“B”或“D”)处酒精灯。
(3)用粗短导管连接D、E的目的是_______ (选填序号)。
a.防堵塞?b.防倒吸?c.平衡气压?d.冷凝回流
E瓶的作用是_______。
(4)F中盛有碱石灰,其目的是_______(选填序号)。
a.吸收HCl ?b.吸收Cl2?c.吸收CO2?d.吸收H2O
(5)将D中固体改为市售氯化铝(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是_______。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为_______。
(6)有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变, 也能制备无水AlCl3。事实证明这样做比较危险,请简述理由_______
参考答案:
(1)NaCl + H2SO4(浓) NaHSO4 + HCl↑;
NaHSO4 + HCl↑;
(2)浓硫酸,B;
(3)a;使AlCl3冷凝、收集AlCl3;
(4)ad;
(5)抑制AlCl3水解;4;
(6)制得的Cl2中混有HCl,与Al反应生成H2,H2与Cl2混合加热时会发生爆炸
本题解析:该实验的原理是先通过发生装置制备HCl气体,然后通过浓硫酸干燥气体,干燥的HCl再与Al反应,最后收集制得的AlCl3。
(1)实验室一般用浓硫酸和NaCl制备HCl气体。
(2)干燥HCl气体用浓硫酸。试验时,应先点燃B处酒精灯,使HCl气体充满装置,再加热D处,防止Al与空气中的O2反应。
(3)AlCl3升华后,易冷凝,若用细导管容易被堵塞。E瓶的作用是将AlCl3冷凝、收集。
(4)F中的碱石灰,可吸收多余的HCl气体,防止污染空气,还可以吸收空气中的水蒸气,防止水蒸气进入E瓶,使AlCl3水解。
(5)若用AlCl3·6H2O制备无水AlCl3,通入HCl是为了防止AlCl3水解。所得碱式氯化铝是原市售氯化铝质量的40%,则可知AlCl3·6H2O转化为Al2(OH)nCl(6-n)后,相对原子质量是原来的40%,即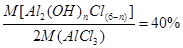 ,代入各原子的相对原子质量,可得n=4。
,代入各原子的相对原子质量,可得n=4。
(6)二氧化锰和浓盐酸反应生成的Cl2中含有HCl,Al与HCl反应会生成H2,H2、Cl2混合加热容易发生爆炸。
本题难度:一般
4、选择题 下列气体中,不能用排空气取气法收集的是( )
A.Cl2
B.SO2
C.NO
D.NH3
参考答案:A.氯气的密度大于空气密度,且不和氧气反应,所以可以采用向上排空气法收集,故A错误;
B.二氧化硫密度大于空气密度,且常温下和氧气不反应,所以可以采用向上排空气法收集,故B错误;
C.一氧化氮和氧气反应生成二氧化氮,所以不能用排空气法收集,故C正确;
D.氨气的密度小于空气,且常温下和氧气不反应,所以可以采用向下排空气法收集,故D错误;
故选C.
本题解析:
本题难度:一般
5、实验题 氯化铝为白色的粉末,遇潮湿空气极易吸收水分并部分水解放出氯化氢而形成酸雾,在183℃升华。工业上由金属铝和氯气作用或用碳氯化法可制得无水氯化铝。某课外兴趣小组在实验室中,通过下图装置制取少量纯净的无水氯化铝。
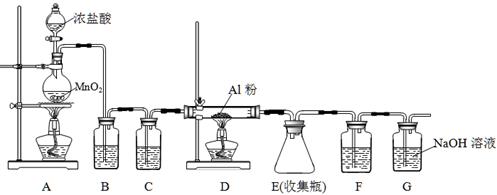
(1)装置A中用于盛装浓盐酸的仪器名称是?,装置A可产生氯气和MnCl2溶液,该反应的化学方程式是?。
(2)装置B中盛放饱和NaCl溶液,该装置的主要作用是?。
(3)装置C、F均盛放浓硫酸,若取消装置C,则可能产生的不良影响是?。
(4)装置D中预期观察到的现象是剧烈燃烧,发出白光,?。
(5)另选一件仪器装入适当试剂后,也可起到F和G的作用,所装填的试剂名称为?。
(6)工业碳氯化法制无水氯化铝是对氧化铝、碳和氯气进行加热,可得副产品一氧化碳,该反应的化学方程式是?。
参考答案:(15分)
(1)分液漏斗(1分);4HCl(浓) + MnO2 MnCl2 + 2H2O + Cl2↑(3分)
MnCl2 + 2H2O + Cl2↑(3分)
(2)吸收氯气中混有的氯化氢气体(2分)
(3)产生的氯化铝固体因吸水、水解而混有杂质(2分)
(4)产生白烟(或白色固体)(2分)
(5)碱石灰(或氢氧化钠固体)(2分)
(6)Al2O3 + 3C + 3Cl2 ?= ?2AlCl3 + 3CO(3分)
本题解析:(1)装置A是制取氯气的实验装置,盛装浓盐酸的仪器名称是分液漏斗,盛装MnO2的仪器名称是圆底烧瓶,在加热条件发生反应生成氯气,反应方程式是4HCl(浓) + MnO2 MnCl2 + 2H2O + Cl2↑。
MnCl2 + 2H2O + Cl2↑。
(2)由于HCl易挥发,故装置B中盛放饱和NaCl溶液的主要作用是吸收氯气中混有的氯化氢气体。
(3)浓硫酸具有干燥作用,若若取消装置C,则可能产生的不良影响是产生的氯化铝固体因吸水、水解而混有杂质。
(4)D中发生氯气和铝生成氯化铝的反应,氯化铝为白色的粉末,故有白烟生成。
(5)F和G的作用的防止空气CO2和水份的进入E中,故可选碱石灰。
(6)根据提供的反应物、反应条件和生成物可写成反应的方程式为Al2O3 + 3C + 3Cl2 ?= ?2AlCl3 + 3CO。
点评:实验室制取氯气的注意事项:
1、必须用浓盐酸,稀盐酸不反应.
2、为了减少制得的氯气中氯化氢的含量,所以加热温度不宜过高,浓盐酸具有挥发性.
3、实验结束后,先使反应停止并排出残留的氯气,再拆卸装置,避免污染空气.
4、尾气吸收时,不能用澄清石灰水吸收氯气,因为溶液中含有氢氧化钙的量少,吸收不完全
本题难度:一般