微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA表示阿伏加德罗常数,下列叙述中正确的是?
A.常温常压下,3.36L NO2和水反应转移的电子数为0.1NA
B.1 molNa2O2与足量的水反应,转移的电子数为2NA
C.在常温常压下,1molFe与1molCl2充分反应,转移的电子数约为3NA
D.在1 L lmol·L-1的氨水中,含有的NH3与NH3·H2O分子的总数小于1mol
参考答案:D
本题解析:A、常温常压下3.36L NO2的物质的量无法计算,错误;B、2Na2O2+2H2O=4NaOH+O2,根据氧气中氧元素的化合价判断,从过氧化钠中的-1到氧气中的0价,化合价升高总数为2,因此2摩尔过氧化钠转移电子为2摩尔,错误;C、1摩尔铁完全反应需要1.5摩尔的氯气,现在氯气只有1摩尔,氯气不足,铁过量,根据氯气计算,1摩尔氯气转移2NA电子,错误;D、氨水是弱电解质,有部分电离,因此,在1 L lmol·L-1的氨水中,含有的NH3与NH3·H2O分子的总数小于1mol,正确。
本题难度:一般
2、选择题 用1 000 g溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量物质的量浓度,其单位是mol·kg-1。5 mol·kg-1的硫酸的密度是1.289 4 g·cm-3,则其物质的量浓度是( )
A.3.56 mol·L-1
B.5.23 mol·L-1
C.4.33 mol·L-1
D.5.00 mol·L-1
参考答案:C
本题解析:
试卷分析:5 mol·kg-1的硫酸表示1000g水中含有5molH2SO4,所以溶液的体积为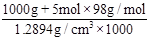 = 1.16L,溶液的物质的量浓度为
= 1.16L,溶液的物质的量浓度为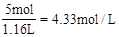 。答案选C。
。答案选C。
点评:本题的关键是根据质量物质的量浓度的定义计算溶液的体积。
本题难度:一般
3、填空题 实验一:称量9.5g?MgCl2溶于水配成100mL溶液;
实验二:取“实验一”配得的Mg?Cl2溶液25.0mL,稀释到500mL.
(1)“实验一”所得MgCl2溶液的物质的量浓度为______,“实验二”所得Mg?Cl2溶液中Cl-的物质的量浓度为______.
(2)以上两个实验中除了用烧杯、量筒、胶头滴管外,还需要用到的玻璃仪器为______.
(3)配制“实验一”的溶液时,以下几个步骤:①量取;②计算;③溶解;④摇匀;⑤转移;⑥洗涤;⑦定容;⑧冷却.其正确操作顺序为______(填序号).
(4)“实验二”中下列操作可引起所配溶液浓度偏高的有______(填序号).
①洗涤量取MgCl2溶液的量筒,并将洗涤液转移到容量瓶中;
②量取MgCl2溶液时,俯视刻度线;
③转移前,容量瓶中含有少量蒸馏水;
④未洗涤稀释MgCl2溶液时用过的烧杯和玻璃棒;
⑤定容时,俯视刻度线.
参考答案:(1)9.5g?MgCl2 的物质的量n=mM=9.5g95g/mol=0.1mol,配成100mL溶液根据公式C=nV=0.1mol0.1L=1mol/L;实验二:取“实验一”配得的Mg?Cl2溶液25.0mL,稀释到500mL,也就是将原溶液稀释20倍,所以,此时MgCl2的浓度为
1mol/L20=0.05mol/L,所得Mg?Cl2溶液中Cl-的物质的量浓度为MgCl2浓度的两倍,0.1mol/L,
故答案为:1mol/L;0.1mol/L;
(2)配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般天平称量固体,把氯化镁倒入烧杯进行溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,配成100mL溶液,实验二:取“实验一”配得的Mg?Cl2溶液25.0mL,稀释到500mL,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、100mL容量瓶、500mL容量瓶,所以还需要100mL容量瓶、500mL容量瓶;玻璃棒,
故答案为:100mL容量瓶;500mL容量瓶;玻璃棒;
(3)配制一定物质的量浓度的溶液的基本步骤:计算、量取、溶解、移液、洗涤、定容、摇匀、装瓶存放等操作.据此可得配制“实验一”的溶液正确操作顺序,故答案为:②①③⑧⑤⑥⑦④;
(4)根据公式C=nV计算分析,不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高.
①洗涤量取MgCl2溶液的量筒,并将洗涤液转移到容量瓶中;量筒在设计时就考虑了不洗涤带来的误差,所以,洗涤量筒只能使配制的浓度偏大,故①正确;
②量取MgCl2溶液时,俯视刻度线;用量筒量取液体时,俯视读数,使所读液体的体积偏小,能使配制的浓度偏小,故②错误;
③转移前,容量瓶中含有少量蒸馏水;容量瓶中有少量水,转移溶液前将容量瓶烘干,对溶质的物质的量、溶液的体积无影响,所以不会造成所配溶液浓度偏高,故③错误;
④未洗涤稀释MgCl2溶液时用过的烧杯和玻璃棒;溶质没有全部转移到容量瓶中,使配制的浓度偏小,故④错误;
⑤定容时,俯视刻度线.定容时俯视容量瓶瓶颈刻度线,会导致溶液的体积偏小,所配制溶液浓度偏高,故⑤正确;故选①⑤;
本题解析:
本题难度:一般
4、选择题 某物质A加热时按下式分解:2A=3B+2C+D(产物均为气体),现测得由生成物组成的混合气体的密度是同温同压下H2密度的22.86倍。则反应物A的相对分子质量为(?)
A.22.86
B.45.72
C.80.01
D.137.16
参考答案:D
本题解析:由生成物组成的混合气体的密度是同温同压下H2密度的22.86倍,则生成物的平均相对分子质量是22.86×2=45.72。设参加反应的A的物质的量是2mol,则根据质量守恒定律可知,2M÷(3+2+1)=45.72,解得M=137.16,所以答案选D。
点评:该题的关键是是依据阿伏加德罗定律及其推论,得出生成物的平均相对分子质量,然后依据质量守恒定律列式计算即可。
本题难度:一般
5、简答题
| 物质 | 分子数
(个) | 质量(m)
(g) | 物质的量(n)
(mol) | 摩尔质量(M)
(g/mol)
|
| 氧气(O2) | 1.204×1023 | ? | ? | 32
|
| H2SO4 | ? | 49 | ? | 98
|
| H2O | ? | ? | 1 | 18
参考答案:n(O2)=1.204×1023?6.02×1023/mol=0.2mol,m(O2)=0.2mol×32g/mol=6.4g;
n(H2SO4)=49g98g/mol=0.5mol,N(H2SO4)=0.5mol×6.02×1023mol-1=3.01×1023;
n(H2O)=1mol,m(H2O)=1mol×18g/mol=18g,N(H2O)=1mol×6.02×1023mol-1=6.02×1023.
故答案为:物质分子数
(个)质量(m)
(g)物质的量(n)
(mol)摩尔质量(M)
(g/mol)氧气(O2)1.204×10236.40.232H2SO43.01×1023490.598H2O6.02×102318118
本题解析:
本题难度:一般
|