微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 将绿矾(FeSO4.7H2O)隔绝空气条件下强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
实验一:为探究固体产物中Fe元素的价态,该同学将固体产物溶于足量的稀H2SO4得到相应溶液,进行以下猜想和实验
猜想
| 实验操作
| 预期现象
|
猜想一:Fe元素只显______价
| ①向所得溶液中滴入KSCN溶液
②向稀酸性KMnO4溶液中滴入所得溶液
| KSCN溶液无明显现象
|
猜想二;Fe元素只显______价
| 稀酸性KMnO4溶液颜色_____
|
猜想三:Fe元素既有+2价又有+3价
| KSCN溶液呈______色
稀酸性KMnO4溶液颜色______
|
?
实验二:为进一步探究该反应的产物,进行了如下图所示的实验
①实验开始时,点燃B处酒精喷灯之前应先打开A处活塞通CO2,其目的是?
?。
②装置图中C的作用是?。
③该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,测得D瓶中沉淀的质量为23.3克,根据这些数据,可以得知,绿矾分解的化学方程式为_____________
④该组同学设计的装置存在着一个明显的缺陷是??
参考答案:
猜想一:+2
猜想二: +3?褪为无色
猜想三:血红色?褪为无色
实验二:
①赶走装置内的空气
②防止产生倒吸
③2FeSO4.7H2O  Fe2O3+SO2+SO3+14H2O
Fe2O3+SO2+SO3+14H2O
④未进行尾气处理
本题解析:略
本题难度:简单
2、实验题 设计一个实验方案,使如图所示装置中的铁棒上析出铜,而铁的质量不变(可用文字叙述,也可用图示意)。
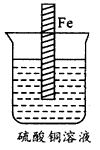
参考答案:方法一:在溶液中再放一锌片,并用导线将锌片与铁片相连,就能达到目的。
方法二:在溶液中再放一石墨棒(或铜棒)并连在直流电源的正极上,再将铁棒连在该电源负极上,调到合适电压,也能在铁棒上析出铜。
本题解析:
本题难度:一般
3、填空题
①将浓氨水逐滴滴入装有生石灰的烧瓶中,可以制取氨气。
②取1mL 20%蔗糖溶液,加入适量稀硫酸,水浴加热约5min后,再加入少量新制的Cu(OH)2,加热,可检验蔗糖是否发生水解。
③配制一定物质的量浓度的NaCl溶液时,定容后摇匀,发现液面又低于刻度线,此时无须再加入蒸馏水。
④用小刀切取少量金属钠做实验,切剩的钠要立即放入原试剂瓶。
⑤在含I—的溶液中加入适量稀硫酸与H2O2(3%),再用酒精萃取,可以提取单质碘。
参考答案:①、③、④(写对1个给2分,写对2个给4分,写对3个给6分,写错1个扣2分,但不出现负分)
本题解析:①将浓氨水逐滴滴入装有生石灰的烧瓶中,生石灰溶于水放出大量的热促进氨水分解放出氨气,故可以制取氨气。正确。
②蔗糖水解加入了稀硫酸,直接加入少量新制的Cu(OH)2,会跟稀硫酸反应使氢氧化铜变成硫酸铜,故加热不会有红色沉淀,无法检验蔗糖是否发生水解。故不对。
③配制一定物质的量浓度的NaCl溶液时,定容后摇匀,有部分溶液附在刻度线上的容量瓶的内壁,故液面会低于刻度线,此时无须再加入蒸馏水。所以此项也正确。
④固体金属单质取用时,一般均要切,但由于剩余的部分由于不对原有金属产生污染,故为节药起见,常放回原试剂瓶,且钠还易在空气中着火,所以立刻放回,故此项正确。
⑤酒精与水互溶,故不能用它萃取水中的碘。
本题难度:一般
4、实验题 某化学兴趣小组在学习“硫酸盐的某些性质和用途”中,进行了如下实验探究:
【实验一】检验(NH4)2Fe(SO4)2·6H2O溶液中含有的阳离子。
(1)在下表中写出操作步骤和实验现象:
限选试剂:新制氯水、1mol/LH2SO4溶液、0.1mol/L KSCN溶液、NaOH浓溶液、浓盐酸、1mol/LNa2CO3溶液
操 作 步 骤
| 实验现象
| 结 论
|
步骤I:取少量待检液于试管中,?
?。
| ?
?
| 溶液中含有Fe2+
|
步骤II:取少量待检液于试管中,?
?。
| ?
?
| 溶液中含有NH4+
|
?
【实验二】用KHSO4制取H2O2并测其质量分数:
查阅资料得知:工业上用电解KHSO4饱和溶液可制取一定浓度的H2O2。兴趣小组进行下列实验测定H2O2的质量分数。已知:2MnO4-+5H2O2+6H+= 2Mn2++8H2O+5O2↑
操作①:取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
操作②:用0.1000 mol/L KMnO4溶液滴定;
操作③:用同样方法滴定,四次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL、22.00 mL。
回答下列问题:
(2)操作②中,开始滴入KMnO4溶液时反应速率很慢,随着KMnO4溶液滴入反应速率显著加快,最有可能的原因______________________。
(3)滴定时盛装KMnO4溶液应选取的仪器是?(填序号)。
A.50mL酸式滴定管 ? B.50mL碱式滴定管
C.25mL酸式滴定管 ? D.25mL碱式滴定管
(4)在上述实验中,下列操作会造成测定结果偏高的有?(填序号)。
A.锥形瓶用待测液润洗
B.量取 H2O2溶液的滴定管用蒸馏水洗净,未用H2O2溶液润洗?
C.滴定速度过快,又未摇匀,停止滴定后发现紫红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(5)分析数据,计算H2O2溶液中溶质的质量百分含量为___________(保留三位有效数字)。
参考答案:(共17分)
(1)(每空2分,共8分)
操作步骤
实验现象
先滴加几滴0.1mol/L KSCN溶液,再滴加适量的新制氯水,振荡
开始时无明显现象;然后溶液呈(血)红色?
滴加适量的NaOH浓溶液,加热,将蘸有浓盐酸的玻璃棒靠近试管口。
?(溶液中产生气泡,管口) 产生白烟
?
(2)反应中生成的 Mn2+具有催化作用? (2分)?
(3)C? (2分);?(4) AD? (2分);?(5)3.40% (3分)
本题解析:(1)从题给试剂和铁离子、亚铁离子的性质设计步骤I的方案,亚铁离子具有还原性,遇KSCN溶液不变红,新制氯水可以将亚铁离子氧化,生成的铁离子遇KSCN溶液变红,因此取少量待测溶液于试管中,先滴加几滴0.1mol/L KSCN溶液,再滴加适量的新制氯水,振荡,开始时无明显现象,然后溶液呈红色,说明溶液中含有Fe2+;根据铵根离子的性质设计步骤II的方案,铵根离子与强碱溶液混合加热时生成氨气,氨气与氯化氢气体混合时产生大量的白烟,氨气可用蘸有浓盐酸的玻璃棒检验,因此取少量待测溶液于试管中,滴加适量NaOH浓溶液,加热,将蘸有浓盐酸的玻璃棒靠近试管口,若溶液中产生气泡、管口产生白烟,说明溶液中含有NH4+;(2)根据外界条件对反应速率的影响规律,刚滴定时浓度最大,反应速率慢,说明不能用浓度、压强解释,由于该反应的反应热未知,也不宜用温度解释,排除之后只有用催化剂解释反应速率先慢后快的原因,即反应中生成的 Mn2+具有催化作用;(3)酸性高锰酸钾溶液具有腐蚀橡胶中碳碳双键的性质,因此只能用酸式滴定管盛装高锰酸钾溶液,由于每次滴定都消耗20mL酸性高锰酸钾溶液,25mL规格的酸式滴定管最接近20mL,可以减少误差,因此C选项正确;(4)锥形瓶用待测液润洗,就会使消耗的酸性高锰酸钾溶液体积增大,导致测定结果偏大,故A选项错正确;量取双氧水的滴定管未润洗,其中的蒸馏水能稀释加入的双氧水,就会使消耗的酸性高锰酸钾溶液体积减小,导致测定结果偏低,故B选项错误;滴定速率过快,未摇匀,停止滴定后紫红色褪去,说明消耗高锰酸钾溶液偏少,导致测定结果偏低,故C选项错误;滴定管上小刻度在上,大刻度在下,二者之差就是消耗标准酸性高锰酸钾溶液的体积,若前读数正确,仰视导致后读数偏大,就会使消耗酸性高锰酸钾溶液体积增大,导致测定结果偏高,故D选项正确;(5)先处理酸性高锰酸钾溶液体积的数据,将异常数据(22.00mL)舍去;再用正常数据求酸性高锰酸钾溶液的平均体积,即(20.00+19.98+20.02)mL/3=20.00mL;然后计算每次滴定消耗高锰酸钾或高锰酸根离子的物质的量,即n(MnO4-)=c?V=0.1000mol/L×20.00×10—3L;由于反应2MnO4-+5H2O2+6H+= 2Mn2++8H2O+5O2↑中过氧化氢与高锰酸根离子的系数之比等于物质的量之比,则5.00mL待测液中n(H2O2)=5n(MnO4-)/2=0.1000mol/L×20.00×10—3L×5/2;接着根据m=n?M求过氧化氢的质量、m=ρ?V 求双氧水溶液的质量,即前者为0.1000mol/L×20.00×10—3L×5/2×34g/mol,后者为1.00g/mL×5.00mL;最后根据溶质的质量除以溶液的质量求溶质的质量分数,即(0.1000mol/L×20.00×10—3L×5/2×34g/mol)/(1.00g/mL×5.00mL)×100%=3.40%(保留三位有效数字)。
本题难度:一般
5、实验题 学习卤代烃的性质时,王老师通过实验的方法验证溴乙烷在不同溶剂中与 NaOH反应生成不同的反应产物,请你一起参与他们的探究。
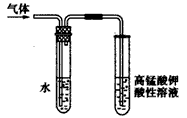
(1)王老师用上图所示装置进行实验:该实验的目的是________ ;观察到的现象是_________ ;盛水试管(装置)的作用是___________。
(2)若你用另一实验来达到王老师上述演示实验的目的,可以选用另一种溶液代替高锰酸钾酸性溶液。你设计的实验方案依据的反应原理是_____________ (用化学方程式表示)。
(3)小明同学取少量溴乙烷与NaOH水溶液反应后混合溶液,向其中滴加AgNO3溶液,加热,产生少量沉淀。 小明由此得出溴乙烷与NaOH水溶液发生取代反应,生成了溴化钠。老师和同学都认为这样不合理。若请你用实验验证该反应中生成了溴化钠,你与小明实验方案的两点不同之处分别是_________。
(4)用波谱的方法能方便地检验溴乙烷发生取代反应的产物,根据你学到的研究有机化合物的方法,使用波谱的名称和波谱仪器记录的结果分别是:____。
参考答案:(1)验证生成的气体是乙烯(或验证溴乙烷与NaOH发生消去反应的产物);高锰酸钾溶液红色褪去;除去气体中少量的乙醇
(2)CH2=CH2+Br2→CH2BrCH2Br
(3)先将混合溶液用HNO3酸化向溴乙烷中加酸化的AgNO3溶液进行对比
(4)核磁共振氢谱图.核磁共振氢谱有三个峰.峰面积之比为 1:2:3(或红外光谱图.发现-OH、C-H、C-O振动吸收
本题解析:
本题难度:一般