微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),请从下图中选用适当的实验装置,设计一个合理而简单的实验,用于测定m的值。其中E装置由甲、乙两 根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0~50 mL),供量气 用,乙管可上下移动,用来调节液面高低。?
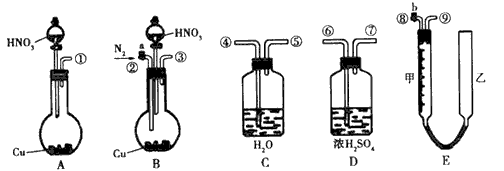
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择__________ (填装置序号)。
(2)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是 __________________。
(3)装置的连接顺序是(填各装置接口的编号,连接胶管及夹持装置均省略) ____________。
(4)连接好装置,检查气密性后,应进行两步必要的操作:第一,打开b,向E装置右管中加适量水;第二,___________。
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应进行的操作是______________。
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为nmol,则用含n和V的式子表示m=______________ 。
参考答案:(1)B
(2)将C中的溶液加适量水稀释
(3)③④⑤⑨
(4)打开a,通足量N2,排净装置中的空气
(5)向下移动乙管,使甲、乙两管液面在同一水平面上
(6)(V-11.2n)/33.6n
本题解析:
本题难度:一般
2、选择题 下列化学实验或操作能够达到目的的是
A.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
B.欲除去蛋白质溶液中的NaCl而又不改变其性质,可加入适量BaCl2溶液后过滤
C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D.为了证明焦炉气中含有氢气,可将焦炉气通过灼热的氧化铜粉末,看黑色粉末是否变红色
参考答案:A
本题解析:A中氢氧化钠和氯化钾不反应,和氯化铝反应生成白色沉淀,氢氧化钠过量时沉淀又溶解。和氯化镁反应生成白色沉淀,氢氧化钠过量时,沉淀不溶解,可以鉴别,A正确;B中氯化钡是重金属盐,能使蛋白质变性,而变性是不可逆的,达不到提纯的目的,B不正确;氯水具有强氧化性,能使Ph试纸氧化而褪色,不能测定其pH值,C不正确;焦炉气中还含义CO,CO也具有还原性,能把氧化铜还原生成单质铜,D不正确,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。侧重对学生实验能力的考查,有利于培养学生规范、严谨的实验设计能力,也有助于培养学生的灵活应变能力。化学实验基本操作,是高考中的热点和重点,需要平时注意知识的积累和总结,该题的易错点是选项C。
本题难度:简单
3、选择题 工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下,对下述流程中的判断正确的是:
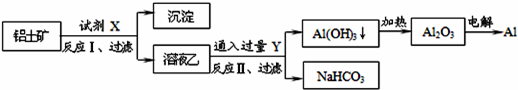
A.试剂X为稀硫酸,沉淀中含有硅的化合物
B.反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-
C.结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2-
D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
参考答案:B
本题解析:A、Al2O3、Fe2O3和硫酸反应,SiO2和硫酸不反应,要将氧化铝和其他两种分离出来,应该选择氢氧化钠,将氧化铝溶解为偏铝酸钠,则固体难溶物是氧化铁和二氧化硅,即试剂X为氢氧化钠,沉淀中含有二氧化硅和氧化铁,故A错误;
B、铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)中加入过量的氢氧化钠以后会生成偏铝酸钠溶液,偏铝酸盐中通二氧化碳来获得氢氧化铝沉淀,即CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故B正确;
C、结合质子的能力就是指碱性,结合质子能力越强,相应的酸放出质子的能力就越弱,其对应的酸的酸性就越弱,显然酸性强弱HCO3->Al(OH)3>H2O,碱性:OH->AlO2->CO32-,所以结合质子能力:OH->AlO2->CO32-,故C错误;
D、氯化铝是分子晶体,熔融时不存在铝离子,电解熔融的氯化铝不能获得金属铝,故D错误.
故选B。
本题难度:一般
4、填空题
①将浓氨水逐滴滴入装有生石灰的烧瓶中,可以制取氨气。
②取1mL 20%蔗糖溶液,加入适量稀硫酸,水浴加热约5min后,再加入少量新制的Cu(OH)2,加热,可检验蔗糖是否发生水解。
③配制一定物质的量浓度的NaCl溶液时,定容后摇匀,发现液面又低于刻度线,此时无须再加入蒸馏水。
④用小刀切取少量金属钠做实验,切剩的钠要立即放入原试剂瓶。
⑤在含I—的溶液中加入适量稀硫酸与H2O2(3%),再用酒精萃取,可以提取单质碘。
参考答案:①、③、④(写对1个给2分,写对2个给4分,写对3个给6分,写错1个扣2分,但不出现负分)
本题解析:①将浓氨水逐滴滴入装有生石灰的烧瓶中,生石灰溶于水放出大量的热促进氨水分解放出氨气,故可以制取氨气。正确。
②蔗糖水解加入了稀硫酸,直接加入少量新制的Cu(OH)2,会跟稀硫酸反应使氢氧化铜变成硫酸铜,故加热不会有红色沉淀,无法检验蔗糖是否发生水解。故不对。
③配制一定物质的量浓度的NaCl溶液时,定容后摇匀,有部分溶液附在刻度线上的容量瓶的内壁,故液面会低于刻度线,此时无须再加入蒸馏水。所以此项也正确。
④固体金属单质取用时,一般均要切,但由于剩余的部分由于不对原有金属产生污染,故为节药起见,常放回原试剂瓶,且钠还易在空气中着火,所以立刻放回,故此项正确。
⑤酒精与水互溶,故不能用它萃取水中的碘。
本题难度:一般
5、选择题 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:

①用0.1000mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数?
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)判断到达滴定终点的现象是??。
(2)某次滴定时的滴定管中的液面如右图所示,其读数为?mL。
(3)根据下列数据:
滴定次数
| 待测液体积(mL)
| 标准盐酸体积(mL)
|
滴定前读数(mL)
| 滴定后读数(mL)
|
第一次
| 20.00
| 0.50
| 25.40
|
第二次
| 20.00
| 4.00
| 29.10
|
请计算待测烧碱溶液的浓度为?mol/L。
(4)下列实验操作会使实验结果偏高的是??。
A、锥形瓶用待测液润洗后再注入待测液
B、酸式滴定管未用标准液润洗,便装入标准液
C、酸式滴定管滴定前俯视读数,滴定后仰视读数
D、酸式滴定管滴定前有气泡,滴定后无气泡
参考答案:(1)溶液由黄色变为橙色,且半分钟不变色。
(2)22.60
(3)0.1250
(4)A、B、C、D
本题解析:略
本题难度:简单